题目内容
2013年9月以来,我国很多地区大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO2等都是形成雾霾的原因.
(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
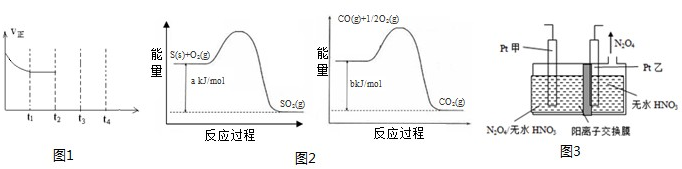
2CO2(g)+N2(g)△H<0,在一定温度下,如图1在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态.
①能判断该反应达到平衡状态的标志是 .
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图1中补充画出从t2到t4时刻正反应速率随时间的变化曲线:
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题.镍与CO反应的化学方程式为Ni(s)+4CO(g)?Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒.为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2.已知相关反应过程的能量变化如图2则用SO2除去CO的热化学方程式为 .
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0.为提高氮氧化物的转化率可采取的措施是(任意填一种) .
(4)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①实验1条件下平衡常数K= (保留小数点后二位);
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是 ;
③该反应的△H O(填“>”或“<”);若在900℃时,另做一组实验,在此容器中加入10mol CO、5mol H2O、2mol CO2、5mol H2,则此时V正 V逆(填“>”或“<”);
(5)工业废气中含有的NO2还可用电解法消除.用NO2为原料可制新型绿色硝化剂N2O5.制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图3.Pt乙为 极,电解池中生成N2O5的电极反应式是 .
(1)用于净化汽车尾气的反应为:2NO(g)+2CO(g)
| 催化剂 |
①能判断该反应达到平衡状态的标志是
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
②在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图1中补充画出从t2到t4时刻正反应速率随时间的变化曲线:

(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题.镍与CO反应的化学方程式为Ni(s)+4CO(g)?Ni(CO)4(g),镍与CO反应会造成镍催化剂中毒.为防止镍催化剂中毒,工业上常用SO2除去CO,生成物为S和CO2.已知相关反应过程的能量变化如图2则用SO2除去CO的热化学方程式为
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.发生的化学反应是:2NH3(g)+NO(g)+NO2(g)
| 180℃ |
| 催化剂 |
(4)已知反应:CO(g)+H2O(g)?CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是
③该反应的△H
(5)工业废气中含有的NO2还可用电解法消除.用NO2为原料可制新型绿色硝化剂N2O5.制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图3.Pt乙为
考点:化学平衡的计算,热化学方程式,化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
②减小压强,正逆反应速率减小,平衡向着气体体积增大的方向移动;
(2)根据图示进行书写;
(3)增大一种反应物浓度,平衡正向移动;
(4)①依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,再计算实验3浓度商,与平衡常数相比判断平衡移动,据此解答;
(5)由N2O4制取N2O5需要是失电子,所以N2O5在阳极区生成.
②减小压强,正逆反应速率减小,平衡向着气体体积增大的方向移动;
(2)根据图示进行书写;
(3)增大一种反应物浓度,平衡正向移动;
(4)①依据图表数据列式计算平衡浓度,结合化学平衡常数概念计算;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量;
③第二组温度比第一组高,反应物物质的量比第一组减半,但是平衡时H2的物质的量比第一组的一半少,表明该反应为放热反应;对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,再计算实验3浓度商,与平衡常数相比判断平衡移动,据此解答;
(5)由N2O4制取N2O5需要是失电子,所以N2O5在阳极区生成.
解答:
解:(1)①A.在单位时间内生成1mol CO2是正反应,同时消耗了1mol CO也是正反应,故A错误;
B.密度=
,总质量不变,体积也不变,故混合气体的密度不再改变不能作为判断是否达到化学平衡状态的依据,故B错误;
C.平均分子量=
,总质量不变,总物质的量会变,故混合气体的平均相对分子质量不再改变可作为判断是否达到化学平衡状态的依据,故C正确;
D.反应前后气体的体积不等,故混合气体的压强不再变化可作为判断是否达到化学平衡状态的依据,故D正确,
故答案为:CD;
②在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图象应该是(见答案).在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向逆反应方向移动,所以正确的图象应该是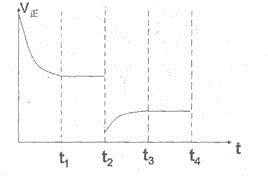 ,
,
故答案为: ;
;
(2)由图二可知,反应物为二氧化硫和一氧化碳,产物为硫和二氧化碳,故热化学方程式为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-(2b-a)kJ?mol-1,
故答案为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-(2b-a)kJ?mol-1;
(3)增大NH3浓度,平衡正向移动,氮氧化物的转化率增大,故答案为:增大NH3浓度;
(4)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 1mol/L 2mol/L 0 0
转化浓度 0.8mol/L 0.8mol/L 0.8mol/L 0.8mol/L
平衡浓度 0.2mol/L 1.2mol/L 0.8mol/L 0.8mol/L
K=
=
=2.67,
故答案为:2.67;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b 的值小于1,
故答案为:a<b;
③实验1中CO的转化率为
×100%=40%,实验2中CO的转化率为
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故△H<0;
对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,
对于反应 CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):2-1.6=0.4 0.4 0.4 0.4
平衡(mol):1.6 1-0.4=0.6 0.4 0.4
900℃时平衡常数k=
=
=
,
实验3的浓度商为Qc=
=
,大于平衡常数,反应向逆反应进行,所以V正<V逆,
故答案为:<;<;
(5)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,故Pt乙为阴极,
故答案为:阴;N2O4+2HNO3-2e-=2N2O5+2H+.
B.密度=
| 总质量 |
| 体积 |
C.平均分子量=
| 总质量 |
| 总物质的量 |
D.反应前后气体的体积不等,故混合气体的压强不再变化可作为判断是否达到化学平衡状态的依据,故D正确,
故答案为:CD;
②在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向正反应方向一定,所以正确的图象应该是(见答案).在t2时刻,将容器的容积迅速扩大到原来的2倍,则正逆反应速率均是减小的,但平衡向逆反应方向移动,所以正确的图象应该是
 ,
,故答案为:
 ;
;(2)由图二可知,反应物为二氧化硫和一氧化碳,产物为硫和二氧化碳,故热化学方程式为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-(2b-a)kJ?mol-1,
故答案为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-(2b-a)kJ?mol-1;
(3)增大NH3浓度,平衡正向移动,氮氧化物的转化率增大,故答案为:增大NH3浓度;
(4)①H2O(g)+CO(g)?CO2(g)+H2(g)
初始浓度 1mol/L 2mol/L 0 0
转化浓度 0.8mol/L 0.8mol/L 0.8mol/L 0.8mol/L
平衡浓度 0.2mol/L 1.2mol/L 0.8mol/L 0.8mol/L
K=
| c(CO2)c(H2) |
| c(H2O)c(CO) |
| 0.8×0.8 |
| 0.2×1.2 |
故答案为:2.67;
②由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b 的值小于1,
故答案为:a<b;
③实验1中CO的转化率为
| 1.6 |
| 4 |
| 0.4 |
| 2 |
对同一反应温度相同,平衡常数相同.根据表中实验2计算900℃时平衡常数,
对于反应 CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):2-1.6=0.4 0.4 0.4 0.4
平衡(mol):1.6 1-0.4=0.6 0.4 0.4
900℃时平衡常数k=
| c(H2)?c(CO2) |
| c(CO)?c(H2O) |
| 0.4×0.4 |
| 1.6×1.6 |
| 1 |
| 6 |
实验3的浓度商为Qc=
| 5×2 |
| 10×5 |
| 1 |
| 5 |
故答案为:<;<;
(5)从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,反应式为N2O4+2HNO3-2e-=2N2O5+2H+,故Pt乙为阴极,
故答案为:阴;N2O4+2HNO3-2e-=2N2O5+2H+.
点评:本题考查化学平衡的影响因素分析判断,平衡常数计算应用,电解池电极反应的书写方法,题目难度较大,学习中注意相关解答方法的积累.

练习册系列答案
相关题目
 如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )
如图是17世纪炼金家们画的带有浓厚神秘色彩的两种同族元素的元素符号.已知X位于周期表前四周期,Y比X多1个电子层,X、Y都是生产半导体的材料,X的氢化物XH3有剧毒.下列推测不正确的是( )| A、原子半径X>Y |
| B、最高价氧化物对应的水化物酸性X>Y |
| C、X的氢化物具有强还原性 |
| D、Y与碘同周期,Y最高价氧化物对应的水化物酸性比高碘酸(HIO4)强 |
下列离子方程式书写正确的是( )
| A、Cl2通入Na2SO3溶液:2Cl2+H2O+SO32-═2HClO+SO2↑+2Cl- |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
C、水杨酸(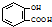 )中加入Na2CO3溶液: )中加入Na2CO3溶液: +CO32-→ +CO32-→ +CO2↑+H2O +CO2↑+H2O |
| D、SO2通入酸性高锰酸钾溶液:5SO2+2MnO4-+2H2O═2Mn2++5SO42-+4H+ |
下列离子方程式书写正确的是( )
| A、碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
| B、铜溶解于氯化铁溶液中:2Fe3++3Cu═2Fe+3Cu2+ |
| C、氯化铝溶液与过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、FeSO4溶液中滴入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
 氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量.
氮气及含氮的化合物在国民经济中占有重要地位.合成氨工业中,合成塔中每产生2mol NH3,放出92.4kJ热量. 丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活.
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活. A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题:
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题: