题目内容
有CO2和NO的混和气体a mL,通过足量的Na2O2后,用排水法收集气体,结果没有收集到气体,则原混和气体中的CO2和NO的体积比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
考点:有关混合物反应的计算
专题:计算题
分析:过氧化钠与二氧化碳反应的方程式为:①2Na2O2+2CO2═2Na2CO3+O2,“用排水法收集气体,结果没有收集到气体”,说明原混合气体中的NO恰好与①生成的氧气反应生成硝酸,反应方程式为:4NO+3O2+2H2O=4HNO3,据此计算出原混和气体中的CO2和NO的体积比.
解答:
解:用排水法收集气体,结果没有收集到气体,说明气体恰好反应生成硝酸,
根据反应①2Na2O2+2CO2═2Na2CO3+O2、②4NO+3O2+2H2O=4HNO3可知,
反应①生成的氧气的体积为原混合气体中NO体积的
,
设反应生成氧气的体积为xmL,则生成xmL氧气消耗二氧化碳的体积为2xmL,
根据反应4NO+3O2+2H2O=4HNO3可知,原混合气体中NO的体积为3xmL,
所以原混和气体中的CO2和NO的体积比为2xmL:3xmL=2:3,
故选C.
根据反应①2Na2O2+2CO2═2Na2CO3+O2、②4NO+3O2+2H2O=4HNO3可知,
反应①生成的氧气的体积为原混合气体中NO体积的
| 1 |
| 3 |
设反应生成氧气的体积为xmL,则生成xmL氧气消耗二氧化碳的体积为2xmL,
根据反应4NO+3O2+2H2O=4HNO3可知,原混合气体中NO的体积为3xmL,
所以原混和气体中的CO2和NO的体积比为2xmL:3xmL=2:3,
故选C.
点评:本题考查混合物反应的有关计算,题目难度中的,侧重对学生综合能力的考查,根据题干信息得出NO与二氧化碳的关系为解答本题的关键.

练习册系列答案
相关题目
木炭、铁粉、二氧化锰、氧化铜、氧化亚铁均为黑色粉末,若只用一种试剂鉴别,应选择下列中的( )
| A、稀硫酸 | B、稀盐酸 |
| C、稀硝酸 | D、浓盐酸 |
仔细分析下列表格中每组醇与酸的关系,找出其关系的共同点,判断X的分子式为( )
| Ⅰ组 | Ⅱ组 | Ⅲ组 | Ⅳ组 | ||
| 醇 | C2H5OH | C4H9OH | X | CH3CH(OH)CH(OH)CH3 | … |
| 酸 | HCOOH | CH3CH2COOH | H2CO3 | HOOC-COOH | … |
| A、C3H10O |
| B、C2H6O2 |
| C、C4H10O |
| D、C3H8O2 |
下列四组溶液中每组都有三种,其中可用稀H2SO4进行鉴别的一组是( )
| A、BaCl2溶液、Ba(NO3)2溶液、NaCl溶液 |
| B、Na2CO3溶液、BaCl2溶液、MgCl2溶液 |
| C、Ba(NO3)2溶液、KCl溶液、MgCl2溶液 |
| D、Na2CO3溶液、K2CO3溶液、NaCl溶液 |
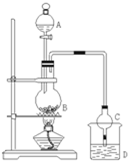 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 有NaOH和Na2CO3混合物l8.6g.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g 则:
有NaOH和Na2CO3混合物l8.6g.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g 则: