题目内容
 有NaOH和Na2CO3混合物l8.6g.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g 则:
有NaOH和Na2CO3混合物l8.6g.为测定其中NaOH的质量,将固体溶于水,并逐渐加入稀硫酸至100g时,开始产生气体;再加入稀硫酸至100g时,不再产生气体,生成气体共4.4g 则:(1)在图中画出产生气体的质量与所加稀硫酸质量的关系曲线.
(2)求混合物中NaOH的质量是多少?
(3)所用稀硫酸的溶质质量分数是多少?
考点:有关混合物反应的计算
专题:计算题
分析:(1)根据题意可以知道,加入100g硫酸之后才开始产生二氧化碳,生成二氧化碳气体的质量为4.4g,消耗硫酸的质量为200g,可以据此完成该题的解答;
(2)根据n=
计算二氧化碳物质的量,根据碳元素守恒计算m(Na2CO3),进而计算NaOH质量;
(3)反应完全时,溶液中溶质为Na2SO4,钠元素守恒计算n(Na2SO4),再根据硫酸根守恒计算n(H2SO4),再根据m=nM计算m(H2SO4),进而计算硫酸溶液质量分数.
(2)根据n=
| m |
| M |
(3)反应完全时,溶液中溶质为Na2SO4,钠元素守恒计算n(Na2SO4),再根据硫酸根守恒计算n(H2SO4),再根据m=nM计算m(H2SO4),进而计算硫酸溶液质量分数.
解答:
解:(1)加入100g硫酸之后才开始产生二氧化碳,生成二氧化碳气体的质量为4.4g,消耗硫酸的质量为200g,产生气体的质量和所加入稀硫酸的质量的关系曲线如图: ,答:产生气体的质量与所加稀硫酸质量的关系曲线
,答:产生气体的质量与所加稀硫酸质量的关系曲线 ;
;
(2)4.4g二氧化碳的物质的量为
=0.1mol,根据碳元素守恒m(Na2CO3)=0.1mol×106g/mol=10.6g,故混合物中氢氧化钠的质量为18.6g-10.6g=8.0g,
答:混合物中氢氧化钠的质量为8.0g;
(3)8.0gNaOH物质的量为
=0.2mol,反应完全时,溶液中溶质为Na2SO4,由钠元素守恒n(Na2SO4)=
=0.2mol,根据硫酸根守恒n(H2SO4)=n(Na2SO4)=0.2mol,故m(H2SO4)=0.2mol×98g/mol=19.6g,硫酸溶液质量分数为
×100%=9.8%,
答:所用稀硫酸的溶质质量分数是9.8%.
 ,答:产生气体的质量与所加稀硫酸质量的关系曲线
,答:产生气体的质量与所加稀硫酸质量的关系曲线 ;
;(2)4.4g二氧化碳的物质的量为
| 4.4g |
| 44g/mol |
答:混合物中氢氧化钠的质量为8.0g;
(3)8.0gNaOH物质的量为
| 8.0g |
| 40g/mol |
| 0.2mol+0.1mol×2 |
| 2 |
| 19.6g |
| 100g+100g |
答:所用稀硫酸的溶质质量分数是9.8%.
点评:本题考查混合物计算,难度不大,明确发生的反应即可计算,本题利用守恒法计算,简化计算过程.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
能用于鉴别蛋白质、淀粉和肥皂液的一种试剂是( )
| A、碘水 |
| B、NaOH溶液 |
| C、浓硝酸 |
| D、MgSO4溶液 |
有CO2和NO的混和气体a mL,通过足量的Na2O2后,用排水法收集气体,结果没有收集到气体,则原混和气体中的CO2和NO的体积比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
石油气中主要成份是烷烃.某石油气充分燃烧后,在相同条件下测得生成的二氧化碳的体积是该石油气体积的1.5倍,则石油气中一定有( )
| A、甲烷 | B、乙烷 | C、丁烷 | D、戊烷 |
在实验室里将浑浊的自来水制成蒸馏水,最好的方法是( )
| A、过滤 | B、萃取 |
| C、蒸发 | D、先过滤后蒸馏 |
某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等).下列分析推理不正确的是( )
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| B、加入混合物9.2g时盐酸过量 |
| C、15.7g混合物未与盐酸完全反应 |
| D、盐酸的物质的量浓度为3.0mol/L |
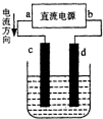 如图是电解饱和食盐水的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解饱和食盐水的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、c为阳极、d为阴极 |
| C、c的电极反应式:2H++2e→H2↑ |
| D、电解过程中,d极的质量增加 |
 实验室制取乙烯的反应原理为:CH3CH2OH
实验室制取乙烯的反应原理为:CH3CH2OH