题目内容
下列有关化学反应原理的说法不正确的是( )
| A、强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 |
| B、过程的自发性既能用于判断过程的方向,也能用于确定过程发生的速率 |
| C、电解质溶液导电的过程中,一定发生了电解质溶液的电解 |
| D、化学变化中,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化 |
考点:焓变和熵变,活化能及其对化学反应速率的影响,电解质溶液的导电性
专题:化学反应中的能量变化,化学反应速率专题
分析:A、酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能接近0;
B、过程的自发性与反应速率无关;
C、电解质溶液导电,可能是电解质电解,也可能是电解电解质和水,也可能是电解水;
D、化学变化中,原子守恒,所谓资源匮乏只是元素的分布发生了变化.
B、过程的自发性与反应速率无关;
C、电解质溶液导电,可能是电解质电解,也可能是电解电解质和水,也可能是电解水;
D、化学变化中,原子守恒,所谓资源匮乏只是元素的分布发生了变化.
解答:
解:A、酸和碱反应不需要外界做功的条件下就能发生,说明它们已经处于活跃状态,因此活化能接近0,故A正确;
B、过程的自发性与反应速率无关,可确定过程能否发生,故B错误;
C、电解质溶液导电,可能是电解质电解如氯化铜溶液电解是氯化铜被电解,也可能是电解电解质和水如硫酸铜溶液,也可能是电解溶剂水,实验一定是电解质溶液电解,故C正确;
D、化学变化中,遵循原子守恒,反应实质是原子的重新组合,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化,故D正确;
故选B.
B、过程的自发性与反应速率无关,可确定过程能否发生,故B错误;
C、电解质溶液导电,可能是电解质电解如氯化铜溶液电解是氯化铜被电解,也可能是电解电解质和水如硫酸铜溶液,也可能是电解溶剂水,实验一定是电解质溶液电解,故C正确;
D、化学变化中,遵循原子守恒,反应实质是原子的重新组合,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化,故D正确;
故选B.
点评:本题考查了反应焓变的分析应用,注意对活化能和化学反应实质的理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
下列关于0.1mol?L-1 NH4Cl溶液的说法正确的是( )
| A、向溶液中加滴加几滴浓盐酸,c(NH4+)减少 |
| B、向溶液中加入少量CH3COONa固体,c(NH4+)减少 |
| C、溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、向溶液中加适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
一定温度下,将等量的气体分别溶入起始体积相同的密闭容器I和II中,使其发生反应,t0时容器I中达到化学平衡,X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )


| A、该反应的化学方程式:3X+2Y=2Z |
| B、若两容器均达到平衡时,两容器的体积V(I)<V(II),则容器II达到平衡所需时间小于t0 |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、若达平衡后对容器II升高温度使其体积增大,说明Z发生的反应为吸热反应 |
 NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A、O2在石墨Ⅱ附近发生氧化反应 |
| B、该电池放电时NO3-向石墨Ⅱ电极迁移 |
| C、石墨Ⅰ附近发生的反应:3NO2+2e-=NO+2NO3- |
| D、相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
下列和乙醇相关的化学用语表达正确的是( )
A、乙醇分子中甲基的电子式为 |
| B、乙醇结构简式为:C2H6O |
C、乙醇分子中羟基电子式: |
D、乙醇分子的比例模型为: |
 利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置进行下列实验,不能得出相应实验结论的是( )
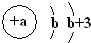

 立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示
立方烷是一种新合成的烃,其分子为正立方体结构,其碳架结构如图所示