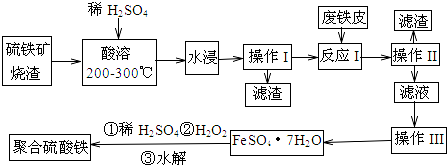
题目内容
19.下列有关能量的判断或表示方法正确的是( )| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
分析 A.气态水变化为液态水过程放热,焓变为负值比较大小;
B.△H=断裂化学键的能量和-成键的能量和;
C.中和热是强酸强碱稀溶液反应生成1mol水放出的热量为中和热,浓硫酸溶解放热;
D.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,液态水为稳定氧化物.
解答 解:A.气态水变化为液态水过程放热,焓变为负值比较大小,等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者,故A正确;
B.△H=反应物中断裂化学键的能量和-生成物中形成化学键的放出能量和,△H<0为放热反应,则破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,反应为放热反应,故B错误;
C.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量大于57.3kJ,故C错误;
D.H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,故D错误;
故选A.
点评 本题考查了化学反应能量变化,反应焓变的计算方法,主要是燃烧热、中和热概念的理解应用,题目难度中等.

练习册系列答案
相关题目
9.1mol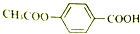 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
7.某化学兴趣小组设计如下方案测定饱和食盐水的电解率.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率.

(1)正确的连接顺序为导管口B(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中铁棒(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
(3)部分实验过程如下:
①用碱式滴定管(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色时停止滴定;
③该小组所测实验数据如表:
未电解前饱和食盐水的物质的量浓度为5.4mol•L-1,经计算,求出该食盐水的电解率为7.4%.
④下列操作,会导致实验结果偏低的是AB(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.
[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%]
方案一:连接图甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率.

(1)正确的连接顺序为导管口B(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中铁棒(填“铁棒”或“碳棒”)附近的溶液变红.
(2)电解饱和食盐水总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率.
(3)部分实验过程如下:
①用碱式滴定管(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;
②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到滴入最后一滴时,锥形瓶中溶液颜色由红色变无色,并保持半分钟不褪色时停止滴定;
③该小组所测实验数据如表:
| 实验序号 | 盐酸体积(mL) |
| 第一组 | 19.90 |
| 第二组 | 24.70 |
| 第三组 | 20.10 |
| 第四组 | 20.00 |
④下列操作,会导致实验结果偏低的是AB(填序号).
A.滴定时锥形瓶中液滴飞溅出来
B.滴定前读数时平视,终点读数时俯视
C.锥形瓶用蒸馏水洗净后没用待测液润洗
D.酸式滴定管尖端气泡没有排除,滴定后消失.
14.下列反应的离子方程式正确的是( )
| A. | 氯碱工业制烧碱:2Cl-+2H2O═H2↑+Cl2↑+2OH- | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH2=CH2↑+Br-+H2O | |
| C. | 向苯酚溶液中滴加过量浓溴水: | |
| D. | 乙醛和含NaOH的新制Cu(OH)2悬浊液共热:2Cu(OH)2+CH3CHO+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
4. CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)下列有关CO2说法不正确额是b(填字母)
a.CO2属于酸性氧化物
b.CO2是导致酸雨发生的主要原因
c.可用Na2CO3溶液捕捉(吸收)CO2
d.使用氢能源替代化石燃料可减少CO2排放
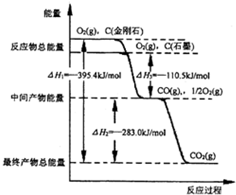
(2)金刚石和石墨燃烧反应中的能量变化如图所示.
①在通常情况下,金刚石和石墨中,石墨(填“金刚石”或“石墨”)更稳定.
②CO的燃烧热为283.0kJ•mol-1.
③石墨不完全燃烧生成CO的热化学方程式为C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体.
已知某些化学键能数据如下表:
已知CO中的键为C≡O,则工业制备甲醇的热化学方程式为CO(g)+2H2 (g)?CH3OH(g)△H=-116kJ/mol.
 CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.
CO2是一种主要的温室气体,研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)下列有关CO2说法不正确额是b(填字母)
a.CO2属于酸性氧化物
b.CO2是导致酸雨发生的主要原因
c.可用Na2CO3溶液捕捉(吸收)CO2
d.使用氢能源替代化石燃料可减少CO2排放
(2)金刚石和石墨燃烧反应中的能量变化如图所示.
①在通常情况下,金刚石和石墨中,石墨(填“金刚石”或“石墨”)更稳定.
②CO的燃烧热为283.0kJ•mol-1.
③石墨不完全燃烧生成CO的热化学方程式为C(s,石墨)+$\frac{1}{2}$O2(g)=CO(g)△H1=-110.5kJ•mol-1.
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
计算298K时由C(s,石墨)和H2(g)生成1molC2H2(g)反应的焓变△H=+226.7kJ•mol-1.
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体.
已知某些化学键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
11.下列有关物质性质或应用的说法中不正确的是( )
| A. | 自来水厂可用明矾作净水剂 | |
| B. | 二氧化硅既能与氢氟酸反应又能与氢氧化钠溶液反应,所以二氧化硅是两性氧化物 | |
| C. | 丁达尔效应是区分胶体与溶液的一种常用方法 | |
| D. | MgO、Al2O3熔点高,可用于制作耐火材料 |
8.铝分别与足量的氢氧化钠溶液和稀盐酸反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl的物质的量之比为( )
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
17. 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了A、B、C中的白色沉淀不是Ag2SO4,实验方法是:取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将C中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
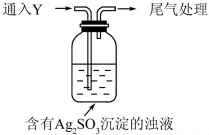
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\stackrel{H+}{→}$2Ag+H2SO4.
 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为2Ag++O2+2SO32-=Ag2SO4↓+SO42-.
该同学设计实验确认了A、B、C中的白色沉淀不是Ag2SO4,实验方法是:取B、C中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将C中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验I的目的是证明X不是Ag2O.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O$\stackrel{H+}{→}$2Ag+H2SO4.