题目内容
8.铝分别与足量的氢氧化钠溶液和稀盐酸反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl的物质的量之比为( )| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
分析 反应的有关方程式为:铝与盐酸:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;假设生成的氢气的物质的量为3mol,根据方程式计算NaOH、HCl的物质的量,氢氧化钠和氯化氢物质的量的之比.
解答 解:令生成的氢气的物质的量为3mol,则:
2Al+6HCl=2AlCl3+3H2↑,
6mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
所以所取氢氧化钠和盐酸溶液中NaOH、HCl的物质的量的之比为2mol:6mol=1:3;
故选C.
点评 本题考查了铝的性质、根据方程式的计算,难度不大,注意有关方程式的书写,根据方程式计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列有关能量的判断或表示方法正确的是( )
| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
16.下列有关工业生产的说法正确的是( )
| A. | 电解饱和食盐水可制得金属钠 | |
| B. | 工业上用焦炭在高温下还原二氧化硅可制得粗硅 | |
| C. | 高炉炼铁的主要反应是高温下焦炭和氧化铁直接作用炼出铁 | |
| D. | 不通过化学变化就可以从海水中提取溴单质 |
3.“宽带中国”战略的阶段性发展目标指出,2015年要基本实现城市光纤到楼入户、农村宽带进乡入村,光纤到户(FTTH)要达0.7亿用户.光纤(光导纤维的简称)的主要成分是( )
| A. | 晶体硅 | B. | 二氧化硅 | C. | 硅酸钠 | D. | 铝硅合金 |
13.向明矾溶液中逐滴加入氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素主要存在的形式是( )
| A. | Al3+和Al(OH)3 | B. | Al(OH)3 | C. | Al(OH)3和AlO2 | D. | AlO2- |
5.化学与生活密切相关,下列说法不正确的是( )
| A. | 煤、石油、天然气是不可再生能源,风能、生物质能、沼气是可再生能源 | |
| B. | “84消毒液”具有强氧化性,可做环境的消毒剂从而预防流感 | |
| C. | 已知水热反应是指在高温高压下,将二氧化碳转化为有机物的技术,则水热反应可以降低自然界中碳的含量 | |
| D. | 已知PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,则PM2.5在空气中有可能形成胶体 |
6.下列实验需要用水浴加热的是( )
| A. | 苯酚的显色反应 | B. | 乙酸乙酯的水解 | ||
| C. | 用乙醇制乙烯 | D. | 乙醛与银氨溶液的反应 |
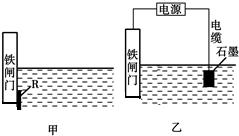 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.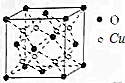 科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.
科学家研究发现金属离子吸收氧气的能力十分巨大,人体血液中的血红蛋白依靠亚铁离子结合氧气,其他金属离子(Cu2+、Zn2+等)也可以实现结合和运输氧气的目的.最近丹麦科学家研发了一种晶体材料,该晶体吸收氧气的能力依靠钴离子,它可以让人在水下持久地获得氧气.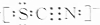 ,则SCN-中σ 键与π键的个数比为1:1.
,则SCN-中σ 键与π键的个数比为1:1.