题目内容
7.一定温度下,反应3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,保持压强不变,充入Ar,其正反应速率C(A.变快 B.不变 C变慢,填字母代号);该反应向不移(填正移、逆移或不移).分析 在一密闭容器中进行达平衡后,保持压强不变,充入Ar,应增大体积,浓度减小,反应前后气体体积不变,压强改变,平衡不移动,以此解答.
解答 解:在一密闭容器中进行达平衡后,保持压强不变,充入Ar,应增大体积,浓度减小,则反应速率减小,反应前后气体体积不变,压强改变,平衡不移动,
故答案为:C;不移.
点评 本题考查化学反应速率影响因素,为高频考点,明确浓度、压强对化学反应速率影响的适用范围,题目难度不大.

练习册系列答案
相关题目
17.阿司匹林(乙酰水杨酸,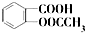 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
主要试剂和产品的物理常数如下表所示:
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
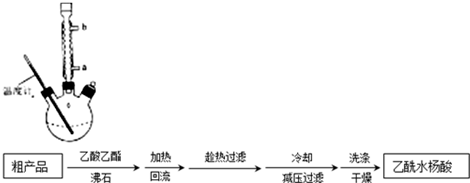
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
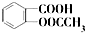 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:

制备基本操作流程如下:
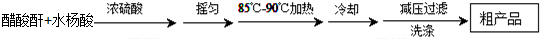
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是醋酸酐和水易发生反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:

①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时大
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
18.FeCO3与砂糖混用可作补血剂,也能被用来制备Fe2O3.
(1)实验室制备FeCO3的流程如下:
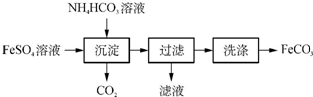
①写出生成沉淀的化学方程式:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O.
②检验滤液中含有NH4+的方法是取少量滤液于试管中,加入足量NaOH溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有NH4+.
(2)甲同学为了验证FeCO3高温下煅烧是否得到Fe2O3,做了如表实验:
根据上述现象得到化学方程式:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
①实验步骤Ⅲ中溶液变红的离子方程式为Fe3++3SCN-=Fe(SCN)3.
②乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后D(填字母),用来检验溶液中是否含有Fe2+.
A.滴加氯水B.滴加KSCN溶液
C.先滴加KSCN溶液后滴加氯水D.滴加酸性KMnO4溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物即为Fe3O4.
①丙同学持此看法的理由是氧化亚铁、四氧化三铁中也是含有+2价铁元素的.
②丙同学查阅资料得知煅烧FeCO3的产物中含有+2价铁元素,于是他设计了由FeCO3制备Fe2O3的方案.先向FeCO3粉末中依次加入试剂:稀硫酸、氯水和氢氧化钠;然后再过滤(填操作)、洗涤、灼烧即可得到Fe2O3.
(1)实验室制备FeCO3的流程如下:

①写出生成沉淀的化学方程式:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O.
②检验滤液中含有NH4+的方法是取少量滤液于试管中,加入足量NaOH溶液,加热,若产生气体可使湿润的红色石蕊试纸变蓝,则滤液中含有NH4+.
(2)甲同学为了验证FeCO3高温下煅烧是否得到Fe2O3,做了如表实验:
| 实验步骤 | 实验操作步骤 |
| Ⅰ | 取一定质量的FeCO3固体置于坩埚中,高温煅烧至质量不再减轻,冷却至室温 |
| Ⅱ | 取少量实验步骤Ⅰ所得固体置于一洁净的试管中,用足量的稀硫酸溶解 |
| Ⅲ | 向实验步骤Ⅱ所得溶液中滴加KSCN溶液,溶液变红 |
①实验步骤Ⅲ中溶液变红的离子方程式为Fe3++3SCN-=Fe(SCN)3.
②乙同学提出了不同的看法:煅烧产物可能是Fe3O4,因为Fe3O4也可以溶于硫酸,且所得溶液中也含有Fe3+.于是乙同学对实验步骤Ⅲ进行了补充:另取少量实验步骤Ⅱ所得溶液,然后D(填字母),用来检验溶液中是否含有Fe2+.
A.滴加氯水B.滴加KSCN溶液
C.先滴加KSCN溶液后滴加氯水D.滴加酸性KMnO4溶液
(3)丙同学认为即使得到乙同学预期的实验现象,也不能确定煅烧产物即为Fe3O4.
①丙同学持此看法的理由是氧化亚铁、四氧化三铁中也是含有+2价铁元素的.
②丙同学查阅资料得知煅烧FeCO3的产物中含有+2价铁元素,于是他设计了由FeCO3制备Fe2O3的方案.先向FeCO3粉末中依次加入试剂:稀硫酸、氯水和氢氧化钠;然后再过滤(填操作)、洗涤、灼烧即可得到Fe2O3.
2. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管,该实验最佳应选用酚酞作指示剂,达到滴定终点的实验现象是:锥形瓶由无色变为浅红色且半分钟内不复原.
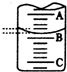
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体 积大于24.60ml.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是CD.
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水洗涤,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体 积大于24.60ml.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水洗涤,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L.
17.1mol•L-1Na2SO4溶液的含义是( )
| A. | 1L溶液中含142gNa2SO4 | B. | 1L溶液中含有1molNa+ | ||
| C. | 将142gNa2SO4溶于1L水中配成溶液 | D. | 1L水中含有1molNa2SO4 |

 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.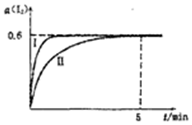 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示