题目内容
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的基态原子核外电子有24种运动状态.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 .
(2)B的氢化物的分子空间构型是 .
(3)写出化合物AC2的电子式 ;
(4)E的核外电子排布式是 ,E的+3价离子核外有 个轨道含有电子.
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,1molD反应时,放热QkJ.该反应的热化学方程式是 .
(1)A、B、C的第一电离能由小到大的顺序为
(2)B的氢化物的分子空间构型是
(3)写出化合物AC2的电子式
(4)E的核外电子排布式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,1molD反应时,放热QkJ.该反应的热化学方程式是
考点:位置结构性质的相互关系应用
专题:
分析:前四周期的元素,它们的核电荷数A<B<C<D<E.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,C形成-2价阴离子,则C为O元素,D为Mg元素,核电荷数B<C,则B为N元素;AC2为非极性分子,则A为C元素;E的基态原子核外电子有24种运动状态,则E核外有24个电子,所以E为Cr,以此来解答.
解答:
解:前四周期的元素,它们的核电荷数A<B<C<D<E.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,C形成-2价阴离子,且D位于C的下一周期,B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高,分子中存在氢键,C形成-2价阴离子,则C为氧元素,D为镁元素,核电荷数B<C,则B为氮元素;AC2为非极性分子,则A为碳元素;E的基态原子核外电子有24种运动状态,则E核外有24个电子,所以E为Cr,
(1)A为C,B为N,C为O,同周期从左到右第一电离能递增,其中第IIA和IIIA,第VA和VIA族反常,则第一电离能由小到大的顺序为C<O<N,
故答案为:C<O<N;
(2)B为氮元素,其氢化物为NH3,分子中的空间构型为三角锥型,
故答案为:三角锥型;
(3)化合物AC2是CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为 ;
;
故答案为: ;
;
(4)E为Cr,其原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,Cr的+3价离子的电子排布式为1s22s22p63s23p63d3,则Cr的+3价离子核外有12个轨道含有电子;
故答案为:1s22s22p63s23p63d54s1;12;
(5)B的最高价氧化物对应的水化物为HNO3的稀溶液与Mg反应时,N被还原到最低价生成物为NH4NO3,1molMg反应时,放热QkJ,该反应的热化学方程式是4Mg(s)+10HNO3(aq)=4Mg(NO3)2(aq)+NH4NO3(aq)+3H2O(l)△H=-4Q kJ?mol-1,
故答案为:4Mg(s)+10HNO3(aq)=4Mg(NO3)2(aq)+NH4NO3(aq)+3H2O(l)△H=-4Q kJ?mol-1.
(1)A为C,B为N,C为O,同周期从左到右第一电离能递增,其中第IIA和IIIA,第VA和VIA族反常,则第一电离能由小到大的顺序为C<O<N,
故答案为:C<O<N;
(2)B为氮元素,其氢化物为NH3,分子中的空间构型为三角锥型,
故答案为:三角锥型;
(3)化合物AC2是CO2,分子中碳原子与氧原子之间形成2对共用电子对,电子式为
 ;
;故答案为:
 ;
;(4)E为Cr,其原子核外有24个电子,其电子排布式为1s22s22p63s23p63d54s1,Cr的+3价离子的电子排布式为1s22s22p63s23p63d3,则Cr的+3价离子核外有12个轨道含有电子;
故答案为:1s22s22p63s23p63d54s1;12;
(5)B的最高价氧化物对应的水化物为HNO3的稀溶液与Mg反应时,N被还原到最低价生成物为NH4NO3,1molMg反应时,放热QkJ,该反应的热化学方程式是4Mg(s)+10HNO3(aq)=4Mg(NO3)2(aq)+NH4NO3(aq)+3H2O(l)△H=-4Q kJ?mol-1,
故答案为:4Mg(s)+10HNO3(aq)=4Mg(NO3)2(aq)+NH4NO3(aq)+3H2O(l)△H=-4Q kJ?mol-1.
点评:本题综合性较大,涉及结构性质越位置关系、元素周期律、电子式与核外电子排布、分子结构,热化学方程式等,题目难度中等,是物质结构的综合性题目,是对学生综合能力的考查,氢化物的沸点比它们同族相邻周期元素氢化物的沸点高是推断的突破口.

练习册系列答案
相关题目
下列离子的检验方法中正确的是( )
| A、某溶液加AgNO3溶液生成白色沉淀,说明原溶液中有Cl- |
| B、某溶液加BaCl2溶液生成白色沉淀,说明原溶液中有SO42- |
| C、某溶液加NaOH溶液生成蓝色沉淀,说明原溶液中有Cu2+ |
| D、某溶液加KOH溶液生成红褐色沉淀,说明原溶液中有Mg2+ |
 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |
 )可用于制造多种高分子材料.现有如下转化关系.
)可用于制造多种高分子材料.现有如下转化关系.

 可以得到制取双酚A的原料,该有机物含苯环的同分异构体还有
可以得到制取双酚A的原料,该有机物含苯环的同分异构体还有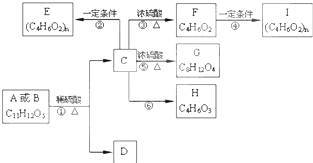 两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.
两种有机物A、B的分子式均为C11H12O5,均能发生如图变化.