题目内容
17.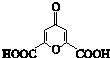 白屈菜有止痛、止咳功效,从其中提取的白屈菜酸的结构简式如图所示,下列有关白屈菜酸(R)的说法中,正确的是( )
白屈菜有止痛、止咳功效,从其中提取的白屈菜酸的结构简式如图所示,下列有关白屈菜酸(R)的说法中,正确的是( )| A. | R能发生氧化、加成、取代反应 | B. | R分子含1个苯环,属于芳香化合物 | ||
| C. | 常温下能与乙醇发生酯化反应 | D. | 1molR与足量钠反应生成2molH2 |
分析 由结构可知,分子中含-COOH、碳碳双键、羰基及醚键,结合羧酸、烯烃等有机物的性质来解答.
解答 解:A.含碳碳双键可发生氧化、加成反应,含-COOH可发生取代反应,故A正确;
B.分子中不含苯环,不是芳香族化合物,故B错误;
C.含-COOH,在浓硫酸、加热条件下与乙醇发生酯化反应,故C错误;
D.由2-COOH~H2可知,1molR与足量钠反应生成1molH2,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
7.我国酒文化源远流长.下列古法酿酒工艺中,以发生化学反应为主的过程是( )
| A. |  酒曲捣碎 | B. |  酒曲发酵 酒曲发酵 | C. |  高温蒸馏 高温蒸馏 | D. |  泉水勾兑 |
8. 工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)═2NO2(g)△H=+133kJ/mol
③H2O(g)═H2O(1)△H=-44kJ/mol
则催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为4H2(g )+2NO2( g)=N2(g )+4H2O(g)△H=-1100.2KJ/mol;
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质).写出该电池的负极反应式:CO-2e-+CO32-=2CO2.
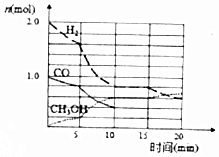
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)?CH3OH(g).某温度下在容积为VL的密闭容器中进行反应,其相关数据如图;反应开始至平衡时,用H2表示化学反应速率为$\frac{0.12}{V}$mol ( L•min ).该温度下CO的平衡转化率为60%.
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
①下列叙述能说明此反应达到平衡状态的是abe.
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡.
若甲中平衡后气体的压强为开始的0.6倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆向反应方向进行,则b的取值可能为b (填序号)
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正> v逆.(填“>”、“<”或“=”)
 工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.
工业燃烧煤、石油等化石燃料释放出大量NOx、CO、CO2等气体,严重污染空气,对废气进行脱硝,脱碳等处理可实现绿色环保、废物利用.Ⅰ、脱硝:
已知:①H2的热值为142.9kJ/g(热值是表示单位质量的燃料完全燃烧生成稳定的化合物时所放出的热量);
②N2(g)+2O2(g)═2NO2(g)△H=+133kJ/mol
③H2O(g)═H2O(1)△H=-44kJ/mol
则催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为4H2(g )+2NO2( g)=N2(g )+4H2O(g)△H=-1100.2KJ/mol;
Ⅱ、脱碳
(1)CO与空气可设计成燃料电池(以熔融的碳酸盐为电解质).写出该电池的负极反应式:CO-2e-+CO32-=2CO2.
(2)甲醇是一种可再生能源,工业上可用合成气制备甲醇,反应为CO(g)+2H2(g)?CH3OH(g).某温度下在容积为VL的密闭容器中进行反应,其相关数据如图;反应开始至平衡时,用H2表示化学反应速率为$\frac{0.12}{V}$mol ( L•min ).该温度下CO的平衡转化率为60%.
(3)向1L密闭容器中加入1molCO2、3molH2,在适当的条件下,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g).
①下列叙述能说明此反应达到平衡状态的是abe.
a.混合气体的平均相对分子质量保持不变
b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等
d.混合气体的密度保持不变
e.1molCO2生成的同时又3molH-H键断裂
②相同条件下,在容积都为1L且固定的两个密闭容器中,按如下方式加入反应物,一段时间后反应达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3molH2 | amol CO2、3amolH2 bmolCH3OH(g)、bmolH2O(g) |
a.0.7 b.0.9 c.1.2
若保持温度不变,起始加入0.5molCO2、0.5molH2、0.5molCH3OH(g)、0.5molH2O(g) 则此反应速率的关系:v正> v逆.(填“>”、“<”或“=”)
5.下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤Na2CO3.
| A. | ③④ | B. | ①②③④ | C. | ②③④ | D. | 全部 |
2.常温下,下列说法不正确的是( )
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 0.1mol•L-1的CH3COOH溶液中,由水电离的c(H+)为1×10-13mol•L-1 | |
| C. | 等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合后溶液的pH<7 | |
| D. | 等体积pH=2的H2SO4溶液和pH=2的CH3COOH溶液混合后溶液的pH=2 |
9.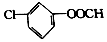 有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )
有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )
 有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )
有机物X的结构简式如图所示,1mol X与足量的NaOH溶液在一定的条件下反应,理论上可以消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
16.下列对物质的量的理解,正确的是( )
| A. | 物质的量就是物质的数量 | |
| B. | 物质的量就是物质的摩尔质量 | |
| C. | 物质的量就是物质所含微粒数目的多少 | |
| D. | 物质的量是一种基本物理量 |
17.下列化合物中不属于有机物的是( )
| A. | 碳化硅(SiC) | B. | 乙酸(CH3COOH) | C. | 乙烯(C2H4) | D. | 酒精 |
 西兰花营养丰富,含蛋白质、淀粉、油脂、叶酸、维生素C和叶绿素,营养成份位居同类蔬菜之首,被誉为“蔬菜皇冠”.
西兰花营养丰富,含蛋白质、淀粉、油脂、叶酸、维生素C和叶绿素,营养成份位居同类蔬菜之首,被誉为“蔬菜皇冠”.