题目内容
15.下列反应的离子方程式书写正确的是( )| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+CO3-+2H2O | |
| C. | 0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
分析 A.反应生成硫酸钡放出热量;
B.加入少量NaHCO3溶液,反应生成碳酸钙、水、NaOH;
C.水解为可逆反应;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H<-57.3kJ/mol,故A错误;
B.向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故B错误;
C.0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红的离子反应为CO32-+H2O?HCO3-+OH-,故C错误;
D.Na2SO3溶液使酸性KMnO4溶液褪色的离子反应为5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,遵循电子、电荷守恒,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
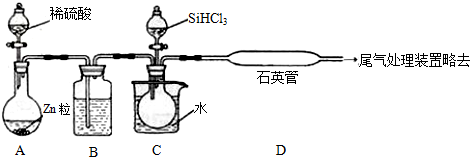
5.化学工业的很多领域都要用到浓硫酸.工业上接触法制硫酸的简单流程如图1.回答有关问题:
(1)下列生产过程中,可用到硫酸的是BCD;
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸纳”的合成
C.铅蓄电池的生产 D.普钙(磷酸二氢钙和硫酸钙)的制备
(2)根据下表信息,结合工业生产实际,判断最适合SO2反应生成SO3的生产条件是400℃,0.1MPa.
(3)由沸腾炉排出的炉渣中含有Fe203、CuO、CuS04(由CuO与SO3化合而成),其中硫酸铜的质量分数随温度变化如表:
己知CuS04在低于660℃时不会分解,请简要分析上表中CuS04的质最分数随温度升高而降低的原因SO2转化为SO3是正反应放热的可逆反应,随温度升高,平衡左移,SO3物质的量减少,所以CuSO4的量减少(或温度升高,SO3物质的量减少,故CuSO4的量减少).
(4)用1t黄铁矿(FeS2的质量分数为36%)接触法制硫酸,硫酸的产率为65%,则通过列式计算最后能生产出98%的浓硫酸的质量为0.39t.
(5)某研究小组用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图2所示.a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.图中a表示阴(填“阴”或“阳”)离子交换膜.A〜E分别代表生产中的原料或产品,其中A为硫酸溶液,则D为NaOH溶液.阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.

(1)下列生产过程中,可用到硫酸的是BCD;
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸纳”的合成
C.铅蓄电池的生产 D.普钙(磷酸二氢钙和硫酸钙)的制备
(2)根据下表信息,结合工业生产实际,判断最适合SO2反应生成SO3的生产条件是400℃,0.1MPa.
 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
(4)用1t黄铁矿(FeS2的质量分数为36%)接触法制硫酸,硫酸的产率为65%,则通过列式计算最后能生产出98%的浓硫酸的质量为0.39t.
(5)某研究小组用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图2所示.a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.图中a表示阴(填“阴”或“阳”)离子交换膜.A〜E分别代表生产中的原料或产品,其中A为硫酸溶液,则D为NaOH溶液.阳极的电极反应式为SO32--2e-+H2O=2H++SO42-.
6.X、Y、Z、W、R均为短周期主族元素,原子序数依次增加,X与W、Y与R分别同主族.Z在短周期元素中金属性最强,W元素原子的次外层电子数为最外层电子数的2倍,R的原子序数是Y的2倍,下列叙述错误的是( )
| A. | 原子半径:W>Y | B. | 最高价含氧酸酸性:W>R | ||
| C. | 气态氢化物稳定性:Y>R | D. | 简单离子半径:Y>Z |
10.通常把原子数和价电子数相同的分子或离子称为等电子体.人们发现等电子体的结构和性质相似.下列有关无机苯(B3N3H6)有关说法中错误的是( )
| A. | B3N3H6分子各原子均在同一平面上 | |
| B. | B3N3H6是由极性键组成的均匀而对称的非极性分子 | |
| C. | B3N3H6能发生加成反应和取代反应 | |
| D. | B3N3H6的二氯取代物有三种 |
20.下列有关说法中正确的是( )
| A. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| D. | 纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一 |
7.含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.
(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
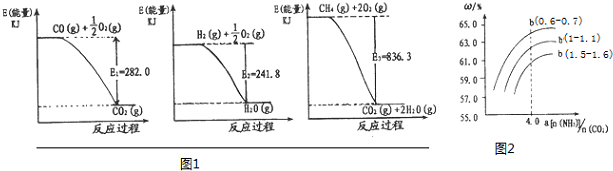
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
①当反应在150℃达到平衡时,该反应平衡常数K=2.8.(填数值)
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为0.10mol/L.
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在C;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是a等于4.0,CO2转化率迅速提高到最大值;而a在4.0之后增大,c(NH3)转化率无明显增大.
(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.

则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
| 时间/S | 0 | 20 | 40 | 60 | 80 |
| N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为0.10mol/L.
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在C;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是a等于4.0,CO2转化率迅速提高到最大值;而a在4.0之后增大,c(NH3)转化率无明显增大.
5.下列有关说法正确的是( )


| A. | 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键 | |
| B. | CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+,4个F- | |
| C. | H原子的电子云图如图3所示,H原子核外大多数电子在原子核附近运动 | |
| D. | 原子堆积模型如图4,可表示Mg原子的堆积方式 |
 .
. .
.