题目内容
7.含氮化合物的研发与绿色反展、经济可持续发展有着密切关联.(1)氨是一种重要化工原料.合成氨原料气H2,可用天然气为原料制得,有关反应能量变化如图1所示.
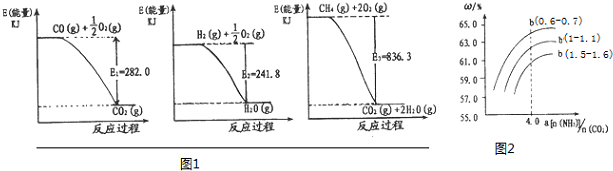
则用CH4(g)和H20(g)反应制得H2(g)和CO(g)的热化学方程式为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+171.1KJ/mol
(2)氮的氧化物有着广泛用途,又是环境的污染物.
(i)在150℃时,将0.4mol NO2气体充入体积为2L的真空密闭容器中,发生反应:2NO2(g)?N2O4(g).
每隔一定时间测定容器内各物质的物质的量,数据如下表:
| 时间/S | 0 | 20 | 40 | 60 | 80 |
| N(NO2)/mol | 0.4 | n1 | 0.26 | n3 | n4 |
| N(N2O4)/mol | 0 | 0.05 | n2 | 0.08 | 0.08 |
②若最初通入N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,则N2O4的起始浓度
应为0.10mol/L.
(ii)氨氧化制HNO3的尾气中含有NO和NO2,且n(NO):n(NO2)=1:1,可用尿素溶液除去,其作用原理是:NO2和NO与水反应生成亚硝酸,亚硝酸再与尿素[CO( NH2)2]反应生成对环境无污
染的物质.若用1mol尿素吸收该尾气,则能吸收氮氧化物76g.
(3)氨气,CO2在一定条件下可合成尿素,其反应为:2NH3(g)+CO2(g)═CO( NH2)2(s)+H2O(g)
图2表示合成塔中氨碳比a与CO2转化率ω的关系.a为[n(NH3):n(CO2)],b为水碳比[n(H2O):n(CO2)].则:
①b应控制在C;
A.1.5~1.6 B.1~1.1 C.0.6~0.7
②a应控制在4.0的理由是a等于4.0,CO2转化率迅速提高到最大值;而a在4.0之后增大,c(NH3)转化率无明显增大.
分析 (1)分别根据图象1、2、3写出热化学方程式,然后根据盖斯定律来分析;
(2)(i).①根据方程式可知,n1=0.3mol,n2=0.07mol,n3=0.24mol,n4=0.24mol,根据NO2的平衡浓度为0.12mol/L、N2O4的平衡浓度为0.04mol/L来计算;
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,即与通入0.4molNO2达等效平衡,据此分析;
(ii)根据题目信息写出方程式,建立关系式,然后依据关系式进行计算;
(3)①根据氨碳比a[n(NH3)/n(CO2)]相同时,水碳比b[n(H2O)/n(CO2)]为0.6~0.7时,二氧化碳转化率最大;
②根据氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.
解答 解:(1)分别根据图象1、2、3可知热化学方程式为:CO(g)+1/2O2(g)=CO2(g)△H=-282KJ/mol ①
H2(g)+1/2O2(g)=H2O(g)△H=-241.8KJ/mol ②
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-836.3KJ/mol ③
将③-①-②×3可得:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol,故答案为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+171.1KJ/mol;
(2)(i)①根据方程式中物质间的计量数关系、利用三段式可知,n1=0.3mol,n2=0.07mol,n3=0.24mol,n4=0.24mol,故在60min时反应达平衡,NO2的平衡浓度为0.12mol/L、N2O4的平衡浓度为0.04mol/L,故反应的平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=$\frac{0.04}{0.1{2}^{2}}$=2.8,故答案为:2.8;
②若最初通人N2O4,在相同条件下达到平衡时,各物质浓度仍然相同,即与通入0.4molNO2达等效平衡,而在恒温恒容条件下,按照等量加料,则达等效平衡,故应加入0.2molN2O4,即0.1mol/L,故答案为:0.1mol/L;
(ii)由题目信息可知,NO、NO2二者混合物与水反应生成亚硝酸,反应方程式为NO+NO2+H2O=2HNO2;亚硝酸再与尿素反应生成CO2和N2,反应方程式为CO (NH2)2+2HNO2=CO2+2N2+3H2O,
NO+NO2 ~2HNO2 ~CO(NH2)2
(30+46)g 1mol
1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1:1)的质量为76g,故答案为:76;
(3)①氨碳比a[n(NH3)/n(CO2)]相同时,水碳比b[n(H2O)/n(CO2)]为0.6~0.7时,二氧化碳转化率最大,故答案为:A;
②氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小,
故答案为:氨碳比a[n(NH3)/n(CO2)]大于4.0时,增大氨气的物质的量,二氧化碳的转化率增加不大,增加了生产成本;氨碳比a[n(NH3)/n(CO2)]小于4.0时,二氧化碳的转化率较小.
点评 本题主要考查了盖斯定律的应用,化学平衡移动、化学平衡常数的计算等,难度不大,培养了学生分析问题的能力.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案 某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:
某同学看到“利用零价铁还原NO3-脱除地下水中硝酸盐”的相关资料后,利用如下装置探究铁粉与KNO3溶液的反应.实验过程如下:i.打开弹簧夹,缓慢通入N2,并保持后续反应均在N2氛围中进行;
ii.加入pH 已调至2.5 的 0.01mol•L-1KNO3酸性溶液100mL,一段时间后铁粉部分溶解,
溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物
质附着;
iii.过滤剩余固体时,表面的白色物质变为红褐色;
iv.检测到滤液中存在NO3-、NH4+和Fe2+.
(1)通入N2并保持后续反应均在N2 氛围中进行的实验目的是避免空气中氧气对Fe与NO3-离子反应的干扰.
(2)白色物质是Fe(OH)2,用化学方程式解释其变为红褐色的原因:4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)用K3[Fe(CN)6]检验滤液中Fe2+的实验方案是取滤液,加入几滴K3[Fe(CN)6]溶液,有蓝色沉淀生成,证明滤液中存Fe2+,.
(4)取少量滤液,向其中加入几滴KSCN 溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色.溶液变成红色的原因是溶液中存在Fe2+、NO3-离子,加入硫酸,发生反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,生成的Fe3+和SCN-反应使溶液呈红色.
(5)该同学进一步查阅资料发现,用铁粉、碳粉的混合物脱除硝酸盐,效果更佳.他用上述KNO3溶液继续设计如下实验,探究碳粉的作用
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入 碳粉一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定NO3-浓度 | Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
| A. | 实验时皮肤受碱腐蚀,先用大量水冲洗,再用2%醋酸溶液或硼酸溶液洗,最后用水冲洗 | |
| B. | 萃取操作时,要快速振摇分液漏斗,放气时支管口不能对着人,也不能对着火 | |
| C. | 淀粉溶液中加入稀硫酸,加热后再加入适量银氨溶液,水浴加热,可以判断淀粉是否水解 | |
| D. | 液态溴乙烷中加入NaOH溶液共热几分钟,然后滴加AgNO3溶液,可以检验溴乙烷中含溴元素 |
| A. | 98.3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol | |
| B. | 向Ca(OH)2溶液中加入少量NaHCO3溶液产生白色沉淀:Ca2++2OH-+2HCO3-═CaCO3↓+CO3-+2H2O | |
| C. | 0.1mol/LNa2CO3溶液中滴入无色酚酞,溶液变红:CO32-+H2O═HCO3-+OH- | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
| A. | 单质的沸点:Y>Z | |
| B. | X、Y、Z三种元素不可能形成离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y分别与Z、W形成的化合物中化学键类型不相同 |
 密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )
密胺是重要的工业原料,结构简式如图.工业上用液氨和二氧化碳为原料,硅胶为催化剂,在一定条件下,通过系列反应生成密胺.若原料完全反应生成密胺,则NH3和CO2的质量之比应为( )| A. | 17:44 | B. | 22:17 | C. | 17:22 | D. | 2:1 |
| A. | 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小 | |
| B. | 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液) | |
| C. | 向0.2 mol•L-1的盐酸溶液中加入等体积0.1 mol•L-1NH3•H2O溶液:c(Cl-)+c(OH-)═c(H+)+c(NH3•H2O) | |
| D. | 在含0.1mol NaHSO4溶液中:c(H+)═c(SO42-)+c(OH-) |
| A. | K Na Li | B. | Al Mg Na | C. | N O C | D. | Cl S P |
| A. | 加入饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸 | |
| B. | 分离苯和硝基苯的混合物,可用蒸馏法 | |
| C. | 除去苯中的杂质苯酚可加入浓溴水后过滤 | |
| D. | 从粗苯甲酸中提纯苯甲酸,可用重结晶法 |