题目内容
(10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL容量瓶中定容成250 mL烧碱溶液; |
| B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL; |
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)
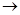
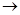
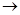 D
D 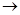 。
。(2)操作D中液面应调整到 。
(3)滴定终点的现象是 。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是 。
(1)C;A;B;D;E;
(2)零刻度或零稍下的某一刻度(不完整不给分)
(3)由黄色变为橙色,且半分钟不变色
(4)偏高
(5)80(V2-V1)c/m %
解析试题分析:(1)正确操作步骤的顺序是C.称取品m g,溶解;配成成250 mL烧碱溶液;移取25 mL烧碱溶液,滴加指示剂;将标准H2SO4溶液装入滴定管,调整液面,记下开始刻度为;在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度。
(2)零刻度以上不能读数,操作D中液面应调整到零刻度或零稍下的某一刻度 。
(3)甲基橙作指示剂,用酸滴定碱,溶液从碱性滴定到终点,滴定终点的现象是由黄色变为橙色,且半分钟不变色 。
(4)若酸式滴定管没有用标准H2SO4润洗,标准H2SO4溶液被稀释,所用H2SO4溶液的体积会偏大,测定结果偏高。
(5)所用硫酸的体积为(V2-V1)/1000L,物质的量为cmol/L×(V2-V1)/1000L,所测氢氧化钠的物质的量为2cmol/L×(V2-V1)/1000L,烧碱样品中氢氧化钠的质量为[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml),该烧碱样品的纯度计算式是[40g/mol×2cmol/L×(V2-V1)/1000L]×(25ml/250ml)÷mg×100%= 80(V2-V1)c/m %。
考点:酸碱中和滴定的操作及计算

下列哪一组元素的原子间反应容易形成离子键
| 原子 | a | b | c | d | e | f | g |
| M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙(其pH变色范围为3.1~4.4)作指示剂,下列操作中可能使测定结果偏低的是
| A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.锥形瓶溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol?L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol?L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol?L-1盐酸和0.1mol?L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
| A.50mL、50mL | B.100mL、100mL |
| C.100mL、150mL | D.250mL、250mL |
通常用于衡量一个国家石油化工发展水平的标志是
| A.石油的产量 | B.乙烯的产量 |
| C.天然气的产量 | D.汽油的产量 |
检验无水乙醇中是否有水的方法是
| A.加金属钠 | B.加入无水硫酸铜 |
| C.加热蒸馏 | D.加无水氯化钙 |
下列仪器:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥烧杯 ⑦试管,常用于物质分离的是
| A.①③④ | B.①②⑥ | C.①③⑤ | D.③④⑦ |
