题目内容
(8分)苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其它食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,制备流程为:
操作步骤如下:① 将一定量的甲苯和碱性KMnO4溶液加热至沸腾,并冷凝回流至混合液不再分层。② 反应停止后,将反应混合液过滤,滤渣为黑色固体;得到的滤液如果呈紫色,可加入少量的饱和亚硫酸钠溶液使紫色褪去,重新过滤。③ 将②中所得滤液经一系列操作得到苯甲酸晶体。
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;
(1)该实验合成苯甲酸钾可能用到的下列仪器有__________。
A.圆底烧瓶 B.蒸馏烧瓶 C.冷凝管 D.温度计
(2)第①步中被回流的主要物质是____________________。
(3)写出滴加饱和亚硫酸钠溶液时的离子方程式______________________________。
(4)步骤③得到苯甲酸晶体应进行操作是________(按操作顺序填正确答案序号)。
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
(8分)(1)A、C(2分);(2)甲苯(2分)
(3)2 MnO4- + H2O + 3SO32-=2 MnO2↓+2 OH- + 3SO42-(2分):(4)A、 C、D 、B(2分)。
解析试题分析:(1)液体混合物加热制取物质应该使用的仪器是圆底烧瓶;将产生的蒸气冷凝的装置是冷凝器,因此该实验合成苯甲酸钾可能用到的仪器是A、C;(2)在常温下甲苯是液体,苯甲酸是固体,所以第①步中被回流的主要物质是甲苯;(3)KMnO4溶液有氧化性,而亚硫酸钠溶液有还原性,二者会发生氧化还原反应,根据电子守恒、原子守恒和电荷守恒可得:离子方程式是2 MnO4- + H2O + 3SO32-=2 MnO2↓+2 OH- + 3SO42-,错误;(4)在步骤③中得到的是苯甲酸钠,首先酸化得到苯甲酸,由于该物质的溶解度随温度的升高而增大,所以再将溶液蒸发浓缩得到高温下饱和苯甲酸,然后冷却结晶就得到苯甲酸晶体,过滤得到苯甲酸晶体。故应进行操作是A、 C、D 、B。
考点:考查仪器的选择、物质的分离步骤、制取方法的两种方程式的书写的知识。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案氨水中有下列平衡NH3·H2O NH4++OH—当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
NH4++OH—当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
| A.加NaOH | B.加HCl | C.加NH4Cl | D.加同浓度的氨水 |
9分)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。
请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入________(填“甲”或“乙”)中。
(3)用标准的盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_______________________________________________________。
(4)直到因加入一滴盐酸后,溶液颜色由________色变为________色,并在30 s内不变,即为终点。
(5)下列操作中可能使所测氢氧化钠溶液浓度偏大的是________。
| A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸。 |
| B.酸式滴定管滴定前有气泡,滴定后气泡消失。 |
| C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥。 |
| D.读取盐酸体积开始时仰视读数,滴定结束后俯视读数。 |
(10分)某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
| A.在250 mL容量瓶中定容成250 mL烧碱溶液; |
| B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴加几滴甲基橙作指示剂; |
| C.在天平上准确称取烧碱样品m g,在烧杯中加蒸馏水溶解; |
| D.将物质的量浓度为c mol·L-1的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度为V1 mL; |
回答下列问题:
(1)正确操作步骤的顺序是(用字母填写)
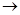
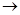
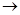 D
D 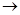 。
。(2)操作D中液面应调整到 。
(3)滴定终点的现象是 。
(4)若酸式滴定管没有用标准H2SO4润洗,会对测定结果有何影响? (填“偏高”、“偏低”或“无影响”,其它操作均正确)。
(5)该烧碱样品的纯度计算式是 。
化学家认为石油、煤作为能源使用时,燃烧了“未来的原始材料”。下列对上述观点理解正确的是
| A.大力提倡使用廉价化石燃料作为能源 |
| B.化石燃料属于可再生能源,不影响可持续发展 |
| C.应更多地利用石油和煤生产基本化工原料 |
| D.研发新型催化剂,提高石油和煤中各组分的燃烧热 |
下列有关化学与生活说法中,不正确的是
A. 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B.大量生产聚乙烯、聚氯乙烯一次性超薄袋,方便日常生活 |
| C.75%的乙醇溶液常用来消毒,是因为酒精能够使细菌蛋白质发生变性 |
| D.页岩气是从页岩层中开采出来的天然气。由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源 |
在标准状况下呈液体的物质为( )
| A.C | B.O2 | C.CH3CH2OH | D.Cl2 |
下列实验操作或事故处理正确的是
| A.金属钠着火,立即用水扑灭 |
| B.实验结束后,用嘴吹灭酒精灯 |
| C.皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 |
| D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
