题目内容
向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )

A、a点对应的溶液中:NH
| ||||||
B、b点对应的溶液中:Na+、S2-、SO
| ||||||
C、c点对应的溶液中:Ag+、Ba2+、K+、NO
| ||||||
D、d点对应的溶液中:K+、S2-、I-、CO
|
考点:离子共存问题
专题:离子反应专题
分析:A.a点没有生成氢氧化铝沉淀,加入的偏铝酸钠步骤,溶液中存在大量氢离子,碳酸氢根离子与铁离子、氢离子反应;
B.b点偏铝酸根离子恰好与氢离子反应生成铝离子,铝离子与硫离子发生双水解反应;
C.c点溶液中存在大量氯离子,氯离子与银离子反应生成氯化银沉淀;
D.d点为偏铝酸钠过量,溶质为偏铝酸钠和氯化钠,K+、S2-、I-、CO32-之间不反应,也不与偏铝酸钠反应.
B.b点偏铝酸根离子恰好与氢离子反应生成铝离子,铝离子与硫离子发生双水解反应;
C.c点溶液中存在大量氯离子,氯离子与银离子反应生成氯化银沉淀;
D.d点为偏铝酸钠过量,溶质为偏铝酸钠和氯化钠,K+、S2-、I-、CO32-之间不反应,也不与偏铝酸钠反应.
解答:
解:A.a点加入的偏铝酸钠溶液步骤,溶液中盐酸过量,溶液显示酸性,Fe3+、HCO3-发生双水解反应,HCO3-与氢离子反应,在溶液中不能大量共存,故A错误;
B.b点偏铝酸钠与溶液中氢离子恰好反应生成AlCl3,S2-与发生双水解反应,在溶液中不能大量共存,故B错误;
C.c点生成氢氧化铝沉淀恰好达到最大量,3AlO2-+6H2O+Al3+═4Al(OH)3↓,溶质为NaCl,Ag+与NaCl反应生成AgCl沉淀,在溶液中不能大量共存,故C错误;
D.d点加入了过量的偏铝酸钠,溶质为NaCl和NaAlO2,K+、S2-、I-、CO32-之间不发生反应,也不与NaCl和NaAlO2反应,在溶液中能够大量共存,故D正确;
故选D.
B.b点偏铝酸钠与溶液中氢离子恰好反应生成AlCl3,S2-与发生双水解反应,在溶液中不能大量共存,故B错误;
C.c点生成氢氧化铝沉淀恰好达到最大量,3AlO2-+6H2O+Al3+═4Al(OH)3↓,溶质为NaCl,Ag+与NaCl反应生成AgCl沉淀,在溶液中不能大量共存,故C错误;
D.d点加入了过量的偏铝酸钠,溶质为NaCl和NaAlO2,K+、S2-、I-、CO32-之间不发生反应,也不与NaCl和NaAlO2反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查了了正负反应、离子方程的判断,题目难度中等,注意掌握离子反应发生条件,明确离子共存的判断方法,正确分析a、b、c、d中溶质的组成为解答本题的关键.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
下列离子方程式正确的是( )
| A、少量的钠跟足量盐酸反应:2Na+2H2O═2Na++2OH-+H2↑ |
| B、过量Cl2通向湿润的淀粉KI试纸,先变蓝后褪去:Cl2+2I-═2Cl-+I2 |
| C、Ba(HCO3)2溶液与Ba(OH)2溶液任意比混合:Ba2++HCO3-+OH-═BaCO3↓+H2O |
| D、向浓HNO3溶液中加入足量的铁粉:Fe+2NO3-+4H+═Fe2++2NO2↑+2H2O |
一定能在下列溶液中大量共存的离子组是( )
| A、能使pH试纸变深蓝色的溶液中,Na+、AlO2-、S2-、CO32- |
| B、由水电离产生的c(H+)=1×10-12mol/L的溶液中:NH4+、Na+、Cl-、HCO3- |
| C、含有大量Fe3+的溶液,SCN-、I-、K+、Br- |
| D、澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42- |
下列说法正确的是( )
| A、增加水的量或提高温度都可以加快镁和水的反应速率 |
| B、增加硝酸的浓度可以加快锌与硝酸反应制取氢气的速率 |
| C、增加CaCO3可以加速CaCO3的分解反应速率 |
| D、增加气态反应物的物质的量,未必增大其反应速率 |
下列各组离子或分子,在溶液中不能大量共存的是( )
| A、NH4+、NO3-、HSO3-、NH3?H2O |
| B、K+、Al3+、SO42-、AlO2- |
| C、Na+、Fe3+、NO3-、MnO4- |
| D、Na+、CH3COO-、CO32-、HCO3- |
已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数
CH3COOH?CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O+?CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
CH3COOH?CH3COO-+H+ K1=1.75×10-5 △H1>0
CH3COO-+H2O+?CH3COOH+OH- K2=5.71×10-10 △H2>0
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
| A、混合溶液PH<7 |
| B、对混合溶液进行微热,K1增大、K2减小 |
| C、调节混合溶液的PH值至中性,则此时溶液中c(Na+)═c(CH3COO-) |
| D、温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
研究发现,空气中少量的NO2能作为催化剂参与硫酸型酸雨的形成,NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是( )
| A、硫化氢通入浓H2SO4中 |
| B、稀H2SO4和乙酸乙酯共热 |
| C、浓H2SO4和C2H5OH共热到170℃ |
| D、潮湿的氯气通过盛有浓H2SO4的洗气瓶 |
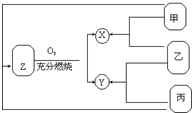 有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问:
有甲、乙、丙三种常见单质,在一定条件下可按如图关系转化为X、Y、Z三种常见的化合物.问: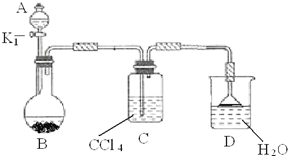 以下为苯的取代反应的探究实验.
以下为苯的取代反应的探究实验.