题目内容
4.下列关于金属的叙述中,说法正确的是( )| A. | 钠在空气中燃烧,产物是Na2O | B. | 钠是银白色金属,硬度大,熔点高 | ||
| C. | 钠在空气中燃烧,发出黄色火焰 | D. | 钠与水反应生成O2 |
分析 A、钠在空气中燃烧,产物是过氧化钠;
B、是一种银白色金属,熔点低,密度小于水,质软;
C、根据钠在空气中燃烧的现象及产物分析判断;
D、钠与水反应生成氢氧化钠和氢气.
解答 解:A、钠在空气中燃烧,产物是过氧化钠,而不是氧化钠,故A错误;
B、是一种银白色金属,熔点低,密度小于水,质软,故B错误;
C、钠在空气中燃烧发出黄色火焰,生成过氧化钠,钠与氧气在常温下反应生成氧化钠,故C正确;
D、钠与水反应生成氢氧化钠和氢气,而不是氧气,故D错误;
故选C.
点评 本题考查了钠的性质,熟悉钠的物质性质和化学性质是解题关键,题目难度不大.

练习册系列答案
相关题目
15.二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命.二甘醇的结构简式是HO-CH2CH2-O-CH2CH2-OH.下列有关二甘醇的叙述正确的是( )
| A. | 不能发生消去反应 | B. | 不能发生取代反应 | ||
| C. | 能溶于水,不溶于乙醇 | D. | 能氧化为醛 |
19.下列物质中含有极性共价键的是( )
| A. | 氯气 | B. | 氯化镁 | C. | 溴化钠 | D. | 水 |
9.利用海水提取溴和镁的过程如下,下列说法不正确的是( )
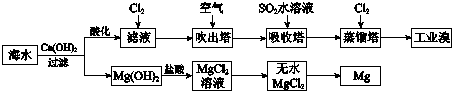

| A. | 工业溴中含少量Cl2,可用NaOH溶液除去 | |
| B. | 工业上常利用电解熔融MgCl2冶炼金属镁 | |
| C. | 富集溴元素过程中,空气吹出法利用了溴易挥发的性质 | |
| D. | 若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2 |
16.下列离子方程式正确的是( )
| A. | 过氧化钠加入水中:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向NaHCO3溶液中滴加NaOH溶液:H++OH -═H2O | |
| C. | 用FeC13溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 向AlC13溶液中加入过量氨水:A13++3NH3•H2O═Al(OH)3↓+3NH4+ |
13.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,0.1mol Al3+含有的核外电子数为0.3NA | |
| B. | 1 mol氯化钠晶体中含有NA个阴离子 | |
| C. | 室温下,pH=12的氢氧化钡溶液所含氢氧根离子数为0.2NA | |
| D. | 电解足量硫酸铜溶液,当电路中转移NA个电子时,阳极生成氧气(标况下)5.6L |
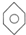 和
和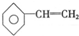 ; E.
; E.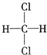 和
和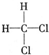 ; F.
; F.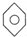 和
和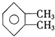 ;
;