题目内容
下列叙述中不正确的是( )
| A、一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C、在0.1mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| D、将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
考点:离子浓度大小的比较,pH的简单计算
专题:
分析:A.醋酸根离子在溶液中部分水解,溶液显示碱性,所以一定浓度的醋酸钠溶液可使酚酞溶液变红;
B.10mL 0.02mol/L HCl溶液与10mL 0.02 mol/L Ba(OH)2溶液充分混合,氢氧化钡过量,混合液显示碱性,计算出混合液中氢氧根离子的物质的量,再计算出混合液的pH;
C.氯化铵溶液中存在电荷守恒,根据电荷守恒判断;
D.假设二者体积都是1L,则n(HCl)=0.2mol,n(NaAlO2)=0.1mol,n(HCl):n(NaAlO2)=0.2mol:0.1mol=2:1,发生的反应为H2O+NaAlO2+HCl=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,NaAlO2完全反应生成沉淀需要0.1molHCl,根据Al原子守恒知生成0.1molAl(OH)3,还剩余0.1molHCl,0.1molHCl溶解Al(OH)3生成AlCl3,所以溶液中的溶质是AlCl3、NaCl,生成AlCl3的物质的量为0.033mol,再结合物料守恒判断离子浓度大小.
B.10mL 0.02mol/L HCl溶液与10mL 0.02 mol/L Ba(OH)2溶液充分混合,氢氧化钡过量,混合液显示碱性,计算出混合液中氢氧根离子的物质的量,再计算出混合液的pH;
C.氯化铵溶液中存在电荷守恒,根据电荷守恒判断;
D.假设二者体积都是1L,则n(HCl)=0.2mol,n(NaAlO2)=0.1mol,n(HCl):n(NaAlO2)=0.2mol:0.1mol=2:1,发生的反应为H2O+NaAlO2+HCl=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,NaAlO2完全反应生成沉淀需要0.1molHCl,根据Al原子守恒知生成0.1molAl(OH)3,还剩余0.1molHCl,0.1molHCl溶解Al(OH)3生成AlCl3,所以溶液中的溶质是AlCl3、NaCl,生成AlCl3的物质的量为0.033mol,再结合物料守恒判断离子浓度大小.
解答:
解:A.醋酸钠溶液中,醋酸根离子发生水解反应:CH3COO-+H2O?CH3COOH+OH-,导致溶液中的c(OH-)>c(H+),溶液显示碱性,则滴入酚酞后溶液变红,故A正确;
B.10mL 0.02mol/L HCl溶液中氯化氢的物质的量为0.000mol,含有0.002mol氢离子;0.02 mol/L Ba(OH)2溶液中氢氧化钡的物质的量为0.0002mol,含有0.0004mol氢氧根离子,两溶液混合后氢氧根离子过量,其物质的量为:0.0004mol-0.0002mol=0.0002mol,混合液中氢氧根离子浓度为:
=0.01mol/L,混合液的pH=12,故B正确;
C.在0.1mol/L NH4Cl溶液中存在电荷守恒:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故C正确;
D.假设二者体积都是1L,则n(HCl)=0.2mol,n(NaAlO2)=0.1mol,n(HCl):n(NaAlO2)=0.2mol:0.1mol=2:1,发生的反应为H2O+NaAlO2+HCl=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,NaAlO2完全反应生成沉淀需要0.1molHCl,根据Al原子守恒知生成0.1molAl(OH)3,还剩余0.1molHCl,0.1molHCl溶解Al(OH)3生成AlCl3,所以溶液中的溶质是AlCl3、NaCl,生成AlCl3的物质的量为0.033mol,铝离子水解而使溶液呈酸性,根据物料守恒知,c(Cl-)最大、其次是c(Na+),铝离子水解但水解程度较小,所以溶液中离子浓度大小顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-),故D错误;
故选D.
B.10mL 0.02mol/L HCl溶液中氯化氢的物质的量为0.000mol,含有0.002mol氢离子;0.02 mol/L Ba(OH)2溶液中氢氧化钡的物质的量为0.0002mol,含有0.0004mol氢氧根离子,两溶液混合后氢氧根离子过量,其物质的量为:0.0004mol-0.0002mol=0.0002mol,混合液中氢氧根离子浓度为:
| 0.0002mol |
| 0.02L |
C.在0.1mol/L NH4Cl溶液中存在电荷守恒:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故C正确;
D.假设二者体积都是1L,则n(HCl)=0.2mol,n(NaAlO2)=0.1mol,n(HCl):n(NaAlO2)=0.2mol:0.1mol=2:1,发生的反应为H2O+NaAlO2+HCl=NaCl+Al(OH)3↓、Al(OH)3+3HCl=AlCl3+3H2O,NaAlO2完全反应生成沉淀需要0.1molHCl,根据Al原子守恒知生成0.1molAl(OH)3,还剩余0.1molHCl,0.1molHCl溶解Al(OH)3生成AlCl3,所以溶液中的溶质是AlCl3、NaCl,生成AlCl3的物质的量为0.033mol,铝离子水解而使溶液呈酸性,根据物料守恒知,c(Cl-)最大、其次是c(Na+),铝离子水解但水解程度较小,所以溶液中离子浓度大小顺序为:c(OH-)<c(H+)<c(Al3+)<c(Na+)<c(Cl-),故D错误;
故选D.
点评:本题考查了溶液中离子浓度大小比较,为高考中的常见考点,属于中等难度试题的考查,试题综合性强,侧重对学生基础知识的巩固和训练,注意掌握电荷守恒、物料守恒、盐的水解原理等知识在判断溶液中离子浓度大小中的应用方法,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力,有助于提升学生的学科素养.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
人造象牙中主要的成分的结构为 ,是通过加聚反应制得的,合成人造象牙的单体是( )
,是通过加聚反应制得的,合成人造象牙的单体是( )
 ,是通过加聚反应制得的,合成人造象牙的单体是( )
,是通过加聚反应制得的,合成人造象牙的单体是( )| A、(CH3)2O |
| B、CH3CHO |
| C、HCHO |
| D、C2H5OH |
将0.1mol?L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
| A、溶液的pH增加 |
| B、促进CH3COOH的电离 |
| C、溶液的导电能力减弱 |
| D、溶液中c(OH-)减少 |
下列微粒半径大小比较不正确的是( )
| A、原子半径Na>Mg |
| B、原子半径F<S |
| C、离子半径Mg2+>O2- |
| D、离子半径Cl->Ca2+ |
下列说法正确的是( )
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、绿色食品是指不含任何化学物质的食品 |
| C、生物固氮是指植物将空气中的氮气转变为氮的化合物 |
| D、光导纤维是以玻璃为主要原料制成的 |
下列反应的现象描述与离子方程式都正确的是( )
| A、金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-═MgCl2+H2↑ |
| B、氯化钡溶液与稀硫酸反应:有白色沉淀生成Ba2++SO42-═BaSO4↓ |
| C、碳酸钠溶液与盐酸反应:有气泡逸出Na2CO3+2H+═2Na++CO2↑+H2O |
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
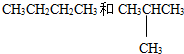 D.甲烷和庚烷E.液氯与氯气
D.甲烷和庚烷E.液氯与氯气 和
和