题目内容
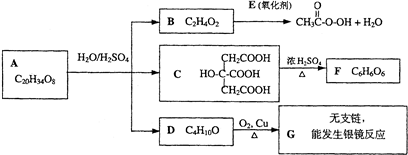
在甲、乙两个密闭容器中,往甲中加入amolSO2和bmolO2,在乙中加入2amolSO2和2bmolO2.在下列条件下,分别反应并达到平衡,比较甲、乙两个容器中SO2的转化率的大小.
(1)等温、等压下,α甲 α乙(填“<”、“>”、“=”,下同)
(2)等温、等容下,α甲 α乙.
(1)等温、等压下,α甲
(2)等温、等容下,α甲
考点:化学平衡的影响因素
专题:化学平衡专题
分析:反应2SO2(g)+O2(g)?2SO3(g)是正反应气体体积减小的反应,加压平衡正向移动,反应物转化率增大,据此分析.
解答:
解:(1)等温、等压下,甲乙两容器中转化率相同,故答案为:=;
(2)等温、等容下,乙容器中的压强比甲容器大,平衡正向移动,反应物转化率增大,故答案为:<.
(2)等温、等容下,乙容器中的压强比甲容器大,平衡正向移动,反应物转化率增大,故答案为:<.
点评:本题考查了外界条件对平衡移动的影响,题目难度中等.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
下列有关实验操作不合理的是( )
| A、用药匙取用粉末状固体 | ||
| B、用胶头滴管滴加大量液体 | ||
C、给盛有
| ||
| D、倾倒液体时试剂瓶标签向手心 |
下列叙述中不正确的是( )
| A、一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C、在0.1mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| D、将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
某硬水中钙、镁离子均以氯化物的形式存在,可用石灰纯碱法将其软化.具体步骤是:先加入石灰将水中的镁离子沉淀,再加入纯碱使水中的钙离子沉淀.发生反应的离子方程式正确的是( )
| A、Ca(OH)2+Mg2+=Mg(OH)2+Ca2+ |
| B、2OH-+Mg2+=Mg(OH)2↓ |
| C、Na2CO3+Ca2+=CaCO3↓+2Na+ |
| D、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH |
在密闭容器中存在下列平衡:CaCO3(s)?CaO(s)+CO2(g),CO2的平衡浓度为C1mol/L,现再充入CO2使其浓度达到2C1mol/L,重新达到平衡后,CO2的浓度为C2mol/L(设温度不变),则C1和C2的关系是( )
| A、C1<C2 |
| B、C1=C2 |
| C、C1>C2 |
| D、2C1=C2 |
质量相等的下列烃完全燃烧时,消耗氧气的量最多的是( )
| A、丙烷 |
| B、丙烯 |
| C、丁炔(C4H6) |
| D、甲苯 |
某同学在实验报告中有以下实验数据:①用托盘天平称取11.7g食盐 ②用量筒量取5.26mL盐酸 ③用广泛pH试纸测得溶液的pH值是3.5 ④用标准NaOH溶液滴定未知浓度的盐酸用去23.10mLNaOH溶液.其中数据合理的是( )
| A、①④ | B、②③ | C、①③ | D、②④ |
从海水中可以提取溴,但得到的液溴中常常溶有少量氯气,除去氯气应该采用的方法是( )
| A、加入适量的NaBr溶液 |
| B、通入溴蒸气 |
| C、加入适量的NaOH溶液 |
| D、加适量的KI溶液 |
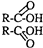
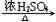
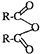 +H2O
+H2O