题目内容
13.如图是无机物A~F在一定条件下的转化关系(部分产物及反应条件未标出).其中A为气体; A~F都含有相同的元素.
试回答下列问题:
(1)写出下列物质的化学式:CNO、FNH4NO3
(2)写出下列反应的化学方程式:
①4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
③3NO2+H2O=2HNO3+NO,该反应氧化剂与还原剂的物质的量之比为1:2.
(3)铜与E的浓溶液反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)25.6g铜与含有1.4mol E的浓溶液恰好完全反应,最终得到气体的体积为(标准状况下)13.44 L.
分析 A为气体,A~F都含有相同的元素,则A为N2,结合图中转化可知,B可发生连续氧化反应,且B为氢化物,B为NH3,C为NO,D为NO2,E为HNO3,F为NH4NO3,以此来解答.
解答 解:(1)由上述分析可知,物质C、F化学式分别为NO、NH4NO3,故答案为:NO;NH4NO3;
(2)化学方程式①为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,③为3NO2+H2O=2HNO3+NO,只有N元素的化合价变化,该反应氧化剂与还原剂的物质的量之比为1:2,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;3NO2+H2O=2HNO3+NO;1:2;
(3)铜与E的浓溶液反应的离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(4)25.6g铜与含有1.4mol E的浓溶液恰好完全反应,n(Cu)=$\frac{25.6g}{64g/mol}$=0.4mol,作酸性的硝酸为0.4mol×2=0.8mol,由N原子守恒可知最终得到气体的体积为(1.4mol-0.8mol)×22.4L/mol=13.44L,故答案为:13.44.
点评 本题考查无机物的推断,为高频考点,把握含氮物质的性质及相互转化为解答的关键,侧重分析与推断能力的考查,注意氢化物连续氧化反应的判断,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
3.两种常见的非金属元素A与B,与常见的三种金属元素C、D、E,A的一种单质是自然界硬度最大的物质,B与C的单质在加热条件下反应生成淡黄色化合物X,D的单质既能与盐酸、也能与NaOH溶液反应生成H2.E的单质与水蒸气反应,生成一种黑色固体Y.请回答下列问题:
(1)X与A的稳定氧化物反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑.
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因Al熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落.
(3)ag C的单质投入足量CuSO4溶液中,下列实验现象正确的有BC.
A.钠沉在溶液底部 B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音 D.生成红色固体物质
可能的离子方程式为2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑.将所得沉淀过滤、洗涤、灼烧,可得到$\frac{40a}{23}$g固体.
(4)为探究黑色固体Y的成分,两探究小组分别用黑色固体Y进行以下实验.
①乙组得到的黑色粉末是FeO.
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+,Fe3++遇SCN-显红色;溶液褪色可能的原因是SCN-被过量Cl2氧化;验证方法为向溶液中再加入KSCN溶液,溶液呈红色,则说明之前SCN-被过量Cl2氧化.
(1)X与A的稳定氧化物反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑.
(2)将D的单质用砂纸打磨,然后灼烧,液态的D并不滴落的原因Al熔点低,氧化铝熔点高,所以熔化的铝被氧化铝兜着,并不滴落.
(3)ag C的单质投入足量CuSO4溶液中,下列实验现象正确的有BC.
A.钠沉在溶液底部 B.熔化成银色光亮的小球
C.小球四处游动发出”嘶嘶”的声音 D.生成红色固体物质
可能的离子方程式为2Na+Cu2++2H2O=Cu(OH)2↓+2Na++H2↑.将所得沉淀过滤、洗涤、灼烧,可得到$\frac{40a}{23}$g固体.
(4)为探究黑色固体Y的成分,两探究小组分别用黑色固体Y进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色固体粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
| 2 | 取步骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O.
③乙组步骤4中,溶液变红的原因为Fe2+被氧化为Fe3+,Fe3++遇SCN-显红色;溶液褪色可能的原因是SCN-被过量Cl2氧化;验证方法为向溶液中再加入KSCN溶液,溶液呈红色,则说明之前SCN-被过量Cl2氧化.
4.下列说法正确的是( )
| A. | 苯和乙烯均含有碳碳双键,均可使溴的CCl4溶液褪色 | |
| B. | 苯( )的一氯代物有一种,丙烷的一氯代物也有一种 )的一氯代物有一种,丙烷的一氯代物也有一种 | |
| C. | 乙醇和乙烯均可与酸性高锰酸钾发生反应 | |
| D. | 所有的有机物都很容易燃烧 |
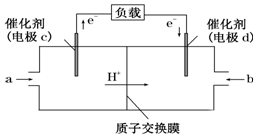
1. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该装置将化学能转化为电能 | |
| B. | 电极b附近的pH值增大 | |
| C. | 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a | |
| D. | 该电池的总反应:2H2+O2═2H2O |
8.医用酒精是常用的消毒剂,它属于( )
| A. | 混合物 | B. | 纯净物 | C. | 酸 | D. | 碱 |
2.下列关于化学用语的表述正确的是( )
| A. | 原子核内有10个中子的氧原子为816O | |
| B. | HClO的结构式为H-O-Cl | |
| C. | 乙烷的分子式为CH3CH3 | |
| D. | NH4Cl的电子式为 |
3.下列物质能使酸性高锰酸钾溶液褪色的是( )
| A. | 甲烷 | B. | 苯 | C. | 环己烷 | D. | 甲苯 |


 .
. .
. .
. ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件): .
.