题目内容
6.化学在文物的保护和鉴定方面发挥着重要的作用.已知氨水能够清洗壁画表面的污垢,醋酸可以固色.某文物保护单位现用500mL容量瓶配制0.1mol•L-1的氨水,以下操作正确的是( )| A. | 将标准状况下1.12 L NH3溶于500 mL水中 | |
| B. | 将标准状况下1.12 L NH3溶于水配成500 mL溶液 | |
| C. | 取1 mol•L-1的氨水50 mL,加入500 mL水中 | |
| D. | 取1 mol•L-1的氨水100 mL,配成1 000 mL溶液 |
分析 A.溶液的体积不是500mL;
B.根据C=$\frac{n}{V}$解题;
C.根据不同液体混合时体积能否直接加和判断;
D.500mL容量瓶只能用来配制500ml溶液.
解答 解:A.体积指溶液体积不是溶剂体积,500mL水溶解氨气后体积增大,溶液的浓度小于0.1mol/L,故A错误;
B.将标准状况下1.12L的氨气的物质的量是0.05mol,根据C=$\frac{n}{V}$=$\frac{0.05mol}{0.5L}$=0.1mol/L,故B正确;
C.1mol/L的氨水50mL与500mL水混合配成溶液的体积不是500mL,所以混合后溶液的物质的量浓度不是0.1mol/L,故C错误;
D.500mL容量瓶只能用来配制500ml溶液,不能配成1000mL溶液,故D错误.
故选:B.
点评 本题考查了有关物质的量浓度的问题,难度不大,注意根据C=$\frac{n}{V}$解题.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
20.一定温度下,对于可逆反应A(g)+2B(g)?3C(g)的下列叙述中,能说明反应已经达到平衡的是( )
| A. | 单位时间内消耗amolA,同时生成3amolC | |
| B. | 容器的压强不再变化 | |
| C. | 混合气体的物质的量不再变化 | |
| D. | C的生成速率与B的生成速率的比为3:2 |
1.下列物质是电解质的是( )
| A. | CuSO4 | B. | 铝 | C. | 甲醛 | D. | 氨水 |
1.对实验现象的观察与分析有助于获得化学知识并学会科学探究的方法.下列对实验现象的分析合理的是
( )
( )
| A. | 某无色溶液中滴入石蕊试液后溶液呈蓝色,证明该溶液一定是碱的溶液 | |
| B. | 向某无色溶液中滴入硝酸银溶液产生白色沉淀,证明该溶液一定是盐酸 | |
| C. | 某白色固体与熟石灰混合研磨后产生有刺激性的氨味,证明该固体是铵盐 | |
| D. | 向某固体中加入稀盐酸产生气泡,证明该固体一定是碳酸盐 |
18.下列关于化学键的叙述正确的是( )
| A. | 单质分子中均存在化学键 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 只有金属元素和非金属元素化合时才能形成离子键 |
 ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.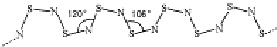
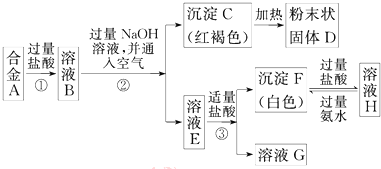
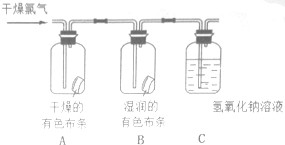 为了验证氯气的有关行政,某同学设计了如下的实验.
为了验证氯气的有关行政,某同学设计了如下的实验. 中含有
中含有 结构.
结构.