题目内容
5.已知A是人类使用最早、应用最广泛的金属之一.根据下图所示的关系填空: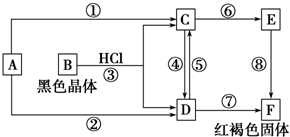
(1)自然界中B主要存在于磁铁矿,化学式为Fe3O4.
(2)为检验D中存在的金属阳离子,一般使用KSCN溶液,现象是溶液出现血红色,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3.
(3)D能与A作用生成C,反应的离子方程式为2Fe3++Fe=3Fe2+.
(4)纯净的E是白色,E→F是通过发生氧化还原或化合反应实现的,F受热分解生成红棕色氧化物,该氧化物是炼铁的主要原料,以该氧化物为原料炼铁的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
分析 A是人类使用最早、应用最广泛的金属之一,结合黑色晶体B、红褐色固体F可知,A为Fe,B为Fe3O4,F为Fe(OH)3,B与盐酸反应生成C、D,C发生⑥⑧转化为氢氧化铁,D一步转化为氢氧化铁,可知C为FeCl2,D为FeCl3,E为Fe(OH)2,结合物质的性质来解答.
解答 解:A是人类使用最早、应用最广泛的金属之一,结合黑色晶体B、红褐色固体F可知,A为Fe,B为Fe3O4,F为Fe(OH)3,B与盐酸反应生成C、D,C发生⑥⑧转化为氢氧化铁,D一步转化为氢氧化铁,可知C为FeCl2,D为FeCl3,E为Fe(OH)2,
(1)自然界中B主要存在于磁铁矿,化学式为Fe3O4,故答案为:磁铁;Fe3O4;
(2)为检验D中存在的金属阳离子,一般使用KSCN溶液,现象是溶液出现血红色,反应的离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:溶液出现血红色;Fe3++3SCN-=Fe(SCN)3;
(3)能与A作用生成C,反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)纯净的E是白色,E→F是通过发生氧化还原或化合反应实现的,F受热分解生成红棕色氧化物,该氧化物是炼铁的主要原料,以该氧化物为原料炼铁的化学方程式为3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:白;氧化还原或化合;红棕;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
点评 本题考查无机物的推断,为高考常见题型,把握物质的性质、发生的反应及相互转化为解答的关键,侧重分析与应用能力的考查,注意铁及其化合物知识的综合应用,题目难度不大.

| A. | K+、Ca2+、HCO3-、SO42- | B. | Cl-、NO3-、Fe2+、K+ | ||
| C. | Na+、OH-、MnO4-、Ba2+ | D. | K+、Mg2+、NO3-、SO42- |
| A. | 五价砷在维生素C作用下发生了还原反应 | |
| B. | “两者同食”发生的反应中维生素C作还原剂 | |
| C. | 河虾中含有的五价砷,没有毒性 | |
| D. | 毒药砒霜是含砷的氧化物,可以推测砒霜中所含的砷元素化合价为+5 |
| A. | 金属性:Na>Mg>Al | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 碱性:NaOH<Mg(OH)2<Al(OH)3 |
| A. | NaOH是氧化产物 | |
| B. | 当1molNaH发生反应时,该反应转移电子的物质的量为2mol | |
| C. | NaH为还原剂 | |
| D. | H2O既是还原剂又是氧化剂 |
 合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.
合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.