题目内容
0.2g H2、2.4g C、19.6g H2SO4、19.5g Zn,它们之间的物质的量之比依次为( )
| A、2:1:2:3 |
| B、1:2:2:3 |
| C、2:1:1:3 |
| D、3:1:2:2 |
考点:物质的量的相关计算
专题:计算题
分析:根据n=
计算氢气、碳、硫酸、锌的物质的量,进而计算物质的量之比.
| m |
| M |
解答:
解:0.2g H2的物质的量=
=0.1mol,
2.4g C的物质的量=
=0.2mol,
19.6g H2SO4的物质的量=
=0.2mol,
19.5g Zn的物质的量=
=0.3mol,
故四种物质的物质的量之比=0.1mol:0.2mol:0.2mol:0.3mol=1:2:2:3,
故选B.
| 0.2g |
| 2g/mol |
2.4g C的物质的量=
| 2.4g |
| 12g/mol |
19.6g H2SO4的物质的量=
| 19.6g |
| 98g/mol |
19.5g Zn的物质的量=
| 19.5g |
| 65g/mol |
故四种物质的物质的量之比=0.1mol:0.2mol:0.2mol:0.3mol=1:2:2:3,
故选B.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
一氧化氮和一氧化碳都是汽车尾气里的有害物质,它们能缓慢地发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)(正反应为放热反应).现利用此反应,拟设计一种环保装置以减轻汽车尾气对大气的污染.下列设计方案可以提高尾气处理效果的是( )
| A、不断向装置中鼓入空气 |
| B、提高反应装置的温度 |
| C、降低反应装置的压强 |
| D、在反应装置中装入碱石灰 |
地沟油、毒胶囊等有关化学污染事件的报道层出不穷,不断有①“致癌农药”②“苏丹红”③“碘元素”④“亚硝酸盐”等化学名词出现.上述化学名词所提到的物质,在某食品添加剂中允许含有且符合限量时不会引起中毒的是( )
| A、②③④ | B、②③ |
| C、③④ | D、只有③ |
 如图所示,用惰性电极电解硫酸铜溶液,下列有关叙述正确的是( )
如图所示,用惰性电极电解硫酸铜溶液,下列有关叙述正确的是( )| A、阴极上的电极反应为:2H++2e-=H2 |
| B、电解一段时间后,溶液的酸碱性不变 |
| C、电解一段时间后,阴极的质量增加,阳极上有大量气泡产生 |
| D、若将石墨电极都换成铁电极,电解一段时间后,两电极质量不变 |
 如图表示一种有机物的结构,关于它的性质的叙述不正确的是( )
如图表示一种有机物的结构,关于它的性质的叙述不正确的是( )| A、有酸性,能与Na2CO3溶液反应 |
| B、1 mol该有机物最多能和8 mol NaOH反应 |
| C、1 mol该有机物与浓溴水反应,最多消耗4 mol Br2 |
| D、它可以水解,水解产物有二种 |
下列说法正确的是( )
| A、用湿润的PH试纸可测溶液的酸碱性 |
| B、用碱式滴定管可量取5.00mLKMnO4溶液 |
| C、碳酸钠溶液可盛放于玻璃瓶塞的试剂瓶内 |
| D、氯水可用棕色试剂瓶保存于阴暗处 |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、碱性氧化物 氧化铁 FeO |
| B、酸性氧化物 碳酸气 CO |
| C、酸 硫酸 H2S |
| D、盐 纯碱 Na2CO3 |
如图的装置能构成原电池并产生较强的电流的是( )
A、 |
B、 |
C、 |
D、 |
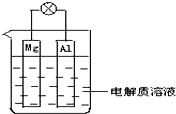 (1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):