题目内容
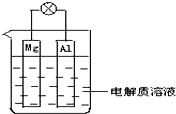 (1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1)如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):①电解质溶液为稀H2SO4时上述装置中灯泡亮,此时Al电极上发生反应的电极反应式为:
②电解质溶液为NaOH溶液时,灯泡
a.若灯泡亮,则Mg电极上发生的电极反应式为:
b.若灯泡不亮,其理由为:
(2)原电池原理的应用之一是可以设计原电池.请利用反应“Cu+2Fe3+=2Fe2++Cu2+”设制一个原电池(正极材料用碳棒)则该电池的负极材料是
(3)氢氧燃料电池(电解质为KOH溶液,惰性材料作电极)负极反应的电极反应式为:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)①Mg、Al和稀硫酸构成原电池,Mg易失电子作负极,Al作正极,正极上氢离子得电子发生还原反应;
②该装置能自发的进行氧化还原反应,所以Mg、Al和NaOH溶液构成原电池,Al易失电子而作负极、Mg作正极,该装置将化学能转化为电能,所以灯泡亮;
(2)根据电池反应式知,Cu易失电子作负极、石墨作正极,电解质为可溶性的铁盐,负极上Cu失电子发生氧化反应,正极上铁离子得电子发生还原反应,根据铜和转移电子之间的关系式计算,作原电池负极的金属加速被腐蚀;
(3)碱性条件下,负极上氢气失电子生成水.
②该装置能自发的进行氧化还原反应,所以Mg、Al和NaOH溶液构成原电池,Al易失电子而作负极、Mg作正极,该装置将化学能转化为电能,所以灯泡亮;
(2)根据电池反应式知,Cu易失电子作负极、石墨作正极,电解质为可溶性的铁盐,负极上Cu失电子发生氧化反应,正极上铁离子得电子发生还原反应,根据铜和转移电子之间的关系式计算,作原电池负极的金属加速被腐蚀;
(3)碱性条件下,负极上氢气失电子生成水.
解答:
解:(1)①该装置为原电池,Mg易失电子作负极、Al作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
②该装置中,铝能和氢氧化钠溶液发生氧化还原反应,该装置符合原电池构成条件,所以Mg、Al和NaOH溶液构成原电池,则灯泡亮;
Al易失电子作负极,负极上电极反应式为2Al-6e-+8OH-=2AlO2-+4H2O,Mg作正极,正极上水得电子生成氢气,正极上的电极反应为6H2O+6e-=6OH-+3H2↑;
故答案为:亮;6H2O+6e-=6OH-+3H2↑;2Al-6e-+8OH-=2AlO2-+4H2O;
(2)根据电池反应式知,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极、石墨作正极,电解质为可溶性的铁盐,负极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为Fe3++e-=Fe2+;
根据Cu-2e-=Cu2+知,导线上转移电子1.5mol,则溶解m(Cu)=
=48g,
Zn和铜离子发生置换反应生成Cu,Zn、Cu和硫酸构成原电池,Zn易失电子作负极、Cu作正极,从而加速Zn的腐蚀,
故答案为:Cu;48g;形成了Zn-Cu原电池,加快了化学反应的速率;
(3)碱性条件下,负极上氢气失电子生成水,负极的电极方程式为H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O.
故答案为:2H++2e-=H2↑;
②该装置中,铝能和氢氧化钠溶液发生氧化还原反应,该装置符合原电池构成条件,所以Mg、Al和NaOH溶液构成原电池,则灯泡亮;
Al易失电子作负极,负极上电极反应式为2Al-6e-+8OH-=2AlO2-+4H2O,Mg作正极,正极上水得电子生成氢气,正极上的电极反应为6H2O+6e-=6OH-+3H2↑;
故答案为:亮;6H2O+6e-=6OH-+3H2↑;2Al-6e-+8OH-=2AlO2-+4H2O;
(2)根据电池反应式知,Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极、石墨作正极,电解质为可溶性的铁盐,负极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,正极上铁离子得电子发生还原反应,电极反应式为Fe3++e-=Fe2+;
根据Cu-2e-=Cu2+知,导线上转移电子1.5mol,则溶解m(Cu)=
| 1.5mol |
| 2 |
Zn和铜离子发生置换反应生成Cu,Zn、Cu和硫酸构成原电池,Zn易失电子作负极、Cu作正极,从而加速Zn的腐蚀,
故答案为:Cu;48g;形成了Zn-Cu原电池,加快了化学反应的速率;
(3)碱性条件下,负极上氢气失电子生成水,负极的电极方程式为H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O.
点评:本题考查了原电池原理,明确原电池正负极的判断方法是解本题关键,原电池原理是高中化学的重点也是难点,要注意掌握原电池原理,把握本质,正确书写电极反应方程式,题目难度中等.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、质量相等状态不同的同种物质,它们的焓相等 |
| B、当反应放热时,△H>0,反应吸热时,△H<0 |
| C、在一个确定的化学反应关系中,反应物的总焓与反应产物的总焓一定不同 |
| D、焓变是指1 mol物质参加反应时的能量变化 |
0.2g H2、2.4g C、19.6g H2SO4、19.5g Zn,它们之间的物质的量之比依次为( )
| A、2:1:2:3 |
| B、1:2:2:3 |
| C、2:1:1:3 |
| D、3:1:2:2 |
 请将氧化还原反应2Fe3++2I-?2Fe2++I2设计成带盐桥(无需指明盐桥构成)的原电池.试剂:FeCl3溶液,KI溶液;其它用品任选.请回答下列问题.
请将氧化还原反应2Fe3++2I-?2Fe2++I2设计成带盐桥(无需指明盐桥构成)的原电池.试剂:FeCl3溶液,KI溶液;其它用品任选.请回答下列问题.