题目内容
16.一个原电池的总反应的离子方程式是Zn+Cu2+═Zn2++Cu,该反应的原电池组成正确的是( )| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Zn |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据电池反应式知,Zn失电子化合价升高作负极,不如锌活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液,据此分析解答.
解答 解:根据电池反应式知,Zn失电子化合价升高作负极,不如锌活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液,
A、应该是Zn作负极、Cu作正极,故A错误;
B、应该是锌作负极、Cu作正极,含铜离子的溶液作电解质溶液,故B错误;
C、Zn作负极、Cu作正极、硫酸铜溶液作电解质溶液可以实现该原电池反应,故C正确;
D、正负极电极材料相同,不能构原电池,故D错误;
故选C.
点评 本题考查原电池原理,明确电池反应中得失电子的物质与正负极材料、电解质溶液的关系是解本题关键,原电池反应还是设计原电池的依据,题目难度不大.

练习册系列答案
相关题目
8.已知反应:5NH4NO3$\stackrel{△}{→}$4N2↑+2HNO3+9H2O,其中被氧化的氮原子与被还原的氮原子个数之比是( )
| A. | 1:1 | B. | 5:3 | C. | 3:5 | D. | 2:1 |
4.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+.下列有关说法正确的是( )
| A. | 电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O | |
| B. | 检测时,电解质溶液中的 H+向负极移动 | |
| C. | 若有 0.4 mol 电子转移,则在标准状况下消耗 4.48 L 氧气 | |
| D. | 正极上发生的反应为:O2+4e-+2H2O═4OH- |
8.化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2-甲基丁烷.若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
| A. | CH3CH2CH2CH2CH2OH | B. | 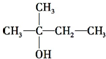 | ||
| C. | 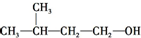 | D. | 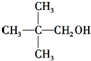 |
5.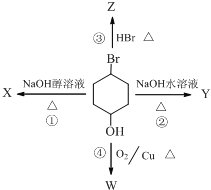 如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
 如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )
如图表示4-溴-1-环己醇所发生的4个不同反应,若生成物只含有一种官能团,则全部符合条件的反应有( )| A. | ①④ | B. | ②③ | C. | ①②③ | D. | ①②③④ |
6.下列化学反应属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | CH2═CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | |
| C. | CH3COOC2H5+H2O$?_{△}^{H+}$CH3COOH+C2H5OH | |
| D. | CH2═CH2+H2$→_{△}^{Ni}$CH2CH3 |
 .
.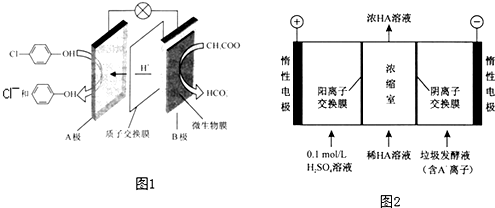
 )的废水可以通过构成微生物电池除去,其原理如图1所示.
)的废水可以通过构成微生物电池除去,其原理如图1所示. -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.