题目内容
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 molCl2与足量Fe反应转移电子数一定为2NA |
| B、常态下,11.2 LCO2和O2混合气体中含NA个氧原子 |
| C、1L 0.1mol/LFeCl3溶液可制备0.1NA个Fe(OH)3胶粒 |
| D、0.1mol/L的醋酸溶液中含有0.1NA个H+ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.1mol氯气与铁完全反应得到2mol电子;
B.不是标准状况下,不能使用标况下的气体摩尔体积计算混合气体的物质的量;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶粒的数目;
D.没有告诉醋酸溶液体积,无法计算溶液中氢离子的数目.
B.不是标准状况下,不能使用标况下的气体摩尔体积计算混合气体的物质的量;
C.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶粒的数目;
D.没有告诉醋酸溶液体积,无法计算溶液中氢离子的数目.
解答:
解:A.1mol氯气与足量的铁完全反应可以得到2mol电子,反应转移电子数一定为2NA,故A正确;
B.没有告诉在标况下,题中条件无法计算二氧化碳和氧气的混合气体的物质的量,故B错误;
C.由于氢氧化铁胶粒为氢氧化铁的聚集体,所以无法计算溶液中氢氧化铁胶粒的物质的量及数目,故C错误;
D.醋酸为弱电解质,且缺少醋酸溶液的体积,无法计算醋酸溶液中氢离子的数目,故D错误;
故选A.
B.没有告诉在标况下,题中条件无法计算二氧化碳和氧气的混合气体的物质的量,故B错误;
C.由于氢氧化铁胶粒为氢氧化铁的聚集体,所以无法计算溶液中氢氧化铁胶粒的物质的量及数目,故C错误;
D.醋酸为弱电解质,且缺少醋酸溶液的体积,无法计算醋酸溶液中氢离子的数目,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确氢氧化铁胶体为氢氧化铁的聚集体,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的组合是( )
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g 金刚石中含有的碳碳键的数目为2NA
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A、a c f h |
| B、a c e g |
| C、a c e f h |
| D、b d e h |
下列实验过程和过程中涉及的离子反应方程式肯定正确的是( )
| A、除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2=2Fe3++2Cl- |
| B、在含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色,5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| C、向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-=BaSO4+NH3?H2O+H2O |
| D、氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
设阿伏伽德罗常数为NA,下列说法正确的是( )
| A、1.8g重水(D2O)中含NA个中子 |
| B、NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
| C、标准状况下,含有NA个分子的氧气和氮气的混和气体的体积约为22.4L |
| D、制取漂白粉的反应中,每消耗7.1g Cl2,则转移0.2NA个电子 |
核电荷数为1~20的元素中,次外层电子数是最外电子层电子数4倍的元素共有( )
| A、4种 | B、3种 | C、2种 | D、1种 |
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1:1和1:2的两种离子化合物.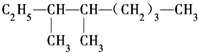 的系统命名法名称是
的系统命名法名称是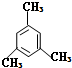 的名称是
的名称是