题目内容
15.室温时,将同种规格的铝片分别投入下列物质中,生成氢气的反应速率最大的是( )| A. | 0.1mol/L盐酸15mL | B. | 0.2mol/L盐酸12mL | ||
| C. | 0.15mol/L硫酸8mL | D. | 18mol/L硫酸15mL |
分析 铝在浓硫酸中发生钝化,不能生成氢气,与硝酸反应生成NO等气体,与其它酸反应本质为2Al+6H+=2Al3++3H2↑,反应开始H+浓度越大,反应越快.
解答 解:铝与浓硫酸在常温下发生钝化反应,不生成氢气;
A、B和C相比较,C中c(H+)较大,反应速率较大,
故选C.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
6.O3氧化海水中的I-是大气中碘的主要来源,将O3通入稀硫酸酸化的NaI溶液中进行模拟研究.
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
(2)为测定生成I2的量,用移液管取20.00mL反应后溶液于锥形瓶中,用 c mol•L-1的Na2S2O3标准液滴定,消耗V mLNa2S2O3溶液.
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cV g•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
(1)为探究外界条件对I2生成速率的影响,做了如下三组实验,填写表中的空白处.
| 编号 | 实验目的 | 反应物 | 反应前 溶液的pH | 温度 |
| 1 | 对照组 | O3+NaI+H2SO4 | 5.2 | 25℃ |
| 2 | ①探究FeCl2对反应速率的影响 | O3+NaI+H2SO4+FeCl2 | 5.2 | ②25℃ |
| 3 | 探究温度对反应速率的影响 | O3+NaI+H2SO4 | ③5.2 | 5℃ |
已知:①H2S2O3是一种弱酸;②2Na2S2O3+I2═Na2S4O6+2NaI
①该滴定实验中除烧杯、锥形瓶外,还需要的玻璃仪器是碱式滴定管;
②该实验中可选用淀粉(填物质名称)作指示剂.
③反应后溶液中碘的含量为6.35cV g•L-1.
④甲同学认为在滴定前应微热溶液,以排除溶液中溶解的O3和O2,不然会使滴定结果偏高(填“低”或“高”).
3.下列有关难溶电解质溶解沉淀平衡的说法不正确的是( )
| A. | 由于Ksp(Ag2S)<Ksp(AgI),向含浓度分别为0.01mol/L的S2-与I-的混合溶液中加入足量的AgNO3(s),只有Ag2S沉淀生成 | |
| B. | FeS在水中的溶解度大于在Na2S溶液中的 | |
| C. | 向含有AgCl(s)的饱和AgCl溶液中加水,固体AgCl质量会减少,但AgCl的溶解度与Ksp均不变 | |
| D. | 达到沉淀溶解平衡时,溶液中离子浓度不一定相等但会保持不变 |
10.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物[ | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同 | |
| B. | 反应①中,当只有少量Cl2时,反应可表示为Cl2+Fe2+═Fe3++2Cl- | |
| C. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| D. | 表中③组反应的离子方程式为2MnO4-+3H2O2+6H+═2Mn2++4O2↑+6H2O |
7.下列化学实验事实及其解释都正确的是( )
| A. | 向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,该现象说明可用CCl4从碘水中萃取碘. | |
| B. | 向某水溶液中滴加盐酸酸化的BaCl2溶液,有白色沉淀生成,说明原溶液中一定含有SO42-离子 | |
| C. | 将饱和氯化铁溶液煮沸,可制得氢氧化铁胶体 | |
| D. | 稀释浓硫酸时将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌 |
4.下列各组的离子,能在溶液中大量共存的是( )
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、Cl-、SO42- | D. | Na、H+、Cl-、CO32- |
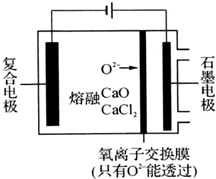 纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
纳米二氧化钛作为一种新型的光催化剂,其用途相当广泛.金属钛具有优良的性能,是航天工业的重要材料.水解法制备纳米二氧化钛和电解钛的过程如下:
 .
.