题目内容
15.下列化学用语书写正确的是( )| A. | 氯原子的结构示意图: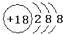 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: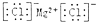 | |
| D. | 用电子式表示氯化氢分子的形成过程:H•+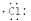 →H+ →H+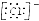 |
分析 A.氯原子含有17个质子;
B.HClO为O分别为H和Cl形成1对共价键;
C.氯化镁为离子化合物,镁离子与两个氯离子通过离子键结合;
D.氯化氢是共价化合物,不存在阴阳离子,氯化氢的电子式不能标出所带电荷;
解答 解:A.氯原子是17号元素,核外电子分为三个电子层,一层2个电子,二层8个电子.三层7个电子,原子结构示意图为 ,故A错误;
,故A错误;
B.HClO为O分别为H和Cl形成1对共价键,结构式为H-O-Cl,故B错误;
C.氯化镁为离子化合物,镁离子与两个氯离子通过离子键结合,电子式: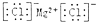 ,故C正确;
,故C正确;
D.化氢为共价化合物,氯化氢分子中不存在阴阳离子,用氯化氢的形成过程为: ,故D错误;
,故D错误;
故选:C.
点评 本题考查了常见化学用语的书写判断,涉及原子结构示意图、电子式的书写,掌握结构式、电子式、结构示意图、化学式等化学用语的概念及表示方法,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
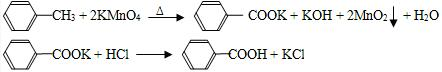
2.苯甲酸应用广泛.实验室用甲苯的氧化制备苯甲酸,反应原理:
3 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O
 ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl
反应试剂、产物的物理常数:
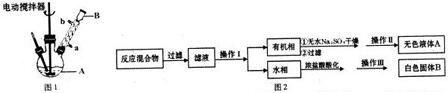
主要实验装置和流程如下(加热装置等略去):
实验方法:
一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,然后按如下流程分离出苯甲酸和回收未反应的甲苯.

(1)无色液体A的结构简式为 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.
(2)如果水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.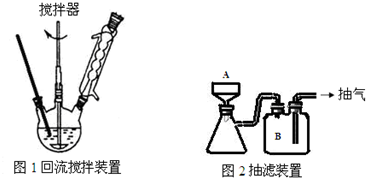
A.图2是抽滤,容器B可以省略
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.图2中仪器A是布氏漏斗
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)证明白色固体B是纯净物测量白色固体B的熔点为122.4℃.
(6)证明苯甲酸是弱酸取0.01mol/L的苯甲酸溶液,测得pH>2.
3
 ─CH3+6KMnO4→3
─CH3+6KMnO4→3 ─COOK+6MnO2+3KOH+3H2O
─COOK+6MnO2+3KOH+3H2O ─COOK+HCl→
─COOK+HCl→ ─COOH+KCl
─COOH+KCl反应试剂、产物的物理常数:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
实验方法:
一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时,反应一段时间,然后按如下流程分离出苯甲酸和回收未反应的甲苯.

(1)无色液体A的结构简式为
 ,操作Ⅱ为蒸馏.
,操作Ⅱ为蒸馏.(2)如果水层呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气.
(3)下列关于仪器的组装或者使用正确的是ABD.

A.图2是抽滤,容器B可以省略
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.图2中仪器A是布氏漏斗
(4)除去残留在苯甲酸中的甲苯应先加入NaOH溶液,分液,水层再加入浓盐酸酸化,然后抽滤,干燥即可得到苯甲酸.
(5)证明白色固体B是纯净物测量白色固体B的熔点为122.4℃.
(6)证明苯甲酸是弱酸取0.01mol/L的苯甲酸溶液,测得pH>2.
3.A、B、C、D、E均为短周期主族元素.A、B、C位于同一周期相邻位置,他们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3:4.E原子半径是短周期元素原子半径最大的.则下列叙述正确的是( )
| A. | C和D能形成D2C2的离子化合物 | |
| B. | 由A、D原子构成的分子的结构是正四面体 | |
| C. | E和C只能形成E2C 一种化合物 | |
| D. | 由A、B、C、D四种元素形成的化合物可以是离子化合物 |
10.甲酸甲酯和甲酸的混合物中,氧元素的质量分数为65%,则碳元素的质量分数为( )
| A. | 15% | B. | 20% | C. | 25% | D. | 30% |
20.化学科学需要借助化学专用语言描述,下列有关化学用语不正确的是( )
| A. | CO2的电子式 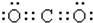 | |
| B. | Cl-的结构示意图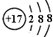 | |
| C. | NaOH的电子式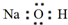 | |
| D. | 原子核内有20个中子的氯原子${\;}_{17}^{37}$Cl |
7.已知反应A2+B2═2AB,破坏1mol A2中的化学键消耗的能量为Q1 kJ,破坏1mol B2中的化学键消耗的能量为Q2 kJ,形成1mol AB中的化学键释放的能量为Q3 kJ,则下列说法正确的是( )
| A. | 若1mol A2和1 mol B2的总能量之和大于生成的1 mol AB的总能量,则反应放热 | |
| B. | 若1mol A2和1 mol B2的总能量之和小于生成的2 mol AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
4.下列有关氢化物的叙述中正确的( )
| A. | 气态氢化物稳定性:PH3>CH4 | |
| B. | HCl的电子式为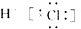 | |
| C. | D2O分子所有原子均达到最外层8e-稳定结构 | |
| D. | VIIA族元素中F的最高价氧化物对应水化物酸性最强 |
5.下列化学用语的表达正确的是( )
| A. | 二氧化碳的比例模型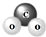 | |
| B. | 原子核内有10个中子的原子:${\;}_{8}^{16}$C | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | Cu基态的外围电子排布图: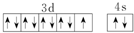 |