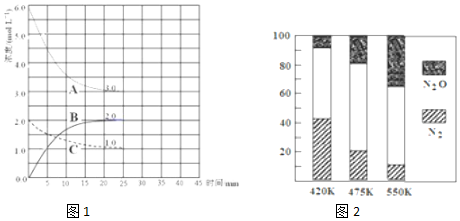
题目内容
10.碱性电池具有容量大,放电电流大的特点,因而得到广泛的应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn+2MnO2+2H2O═Zn(OH)2+MnOOH,下列说法不正确的是( )| A. | 电池工作时锌为负极 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电解液的OH-移向正极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
分析 由Zn+2MnO2+2H2O═Zn(OH)2+MnOOH可知,Zn失去电子作负极,Mn得到电子,阴离子向负极移动,以此来解答.
解答 解:A.Zn失去电子,为原电池的负极,故A正确;
B.Mn得到电子,正极发生还原反应为2MnO2+2H2O+2e-═2MnOOH+2OH-,故B正确;
C.电池工作时,电解液的OH-移向负极,故C错误;
D.外电路中每通过0.2mol电子,消耗0.1molZn,则锌的质量理论上减少0.1mol×65g/mol=6.5g,故D正确;
故选C.
点评 本题考查原电池,为高频考点,把握电池反应中元素的化合价变化、原电池的工作原理为解答的关键,侧重分析与应用能力的考查,注意转移电子与物质的量计算,题目难度不大.

练习册系列答案
相关题目
17.按照氟、氯、溴、碘的顺序,下列递变规律中正确的是( )
| A. | 单质的熔、沸点逐渐降低 | B. | 与H2反应越来越容易 | ||
| C. | F-、Cl-、Br-、I-的还原性逐渐增强 | D. | 单质的氧化性逐渐增强 |
18.下列关于NA的说法正确的是( )
| A. | 1molNa2O2与足量H2O充分反应转移的电子数为2NA | |
| B. | 200mL,1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子总数为6.02×1023 | |
| C. | 已知2A(g)+B(g)═2C(g)△H=-akJ/mol,若将2NA个A与NA个B混合充分反应放出akJ的热量 | |
| D. | 28gSi3N4晶体中含有的硅氮键的数目为2.4NA |
15.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )
| A. | 该反应中FeSO4只做还原剂,Na2O2只做氧化剂 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 该反应中由4 mol Fe2+还原的Na2O2是3 mol | |
| D. | 反应中氧化剂与还原剂的物质的量之比为3:5 |
2.下列说法中正确的是( )
| A. | 1mol 任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积也是22.4L | |
| C. | lmol H2气态物质,当体积为22.4L 时,该气体一定处于标准状 | |
| D. | 2mol 气体体积约为44.8L |
19.阿伏加德罗常数的值为6.02×1023mol-1,下列说法中正确的是( )
| A. | 0.5 L 1 mol•L-1 MgCl2溶液中含有的Cl-数目为0.5×6.02×1023 | |
| B. | 在0℃、101kPa时,22.4 L H2中含有6.02×1023个氢原子 | |
| C. | 14 g N2中含有6.02×1023个原子 | |
| D. | 6.02×1023个CO2分子与0.5 mol CH4的质量比为7:4 |
20.最近科学家在洛夫乔伊彗星上侦测到乙醇和乙醇醛(HOCH2CHO ),下列说法不正确的是( )
| A. | 乙醇和乙醇醛都能发生加成反应 | |
| B. | 乙醇和乙醇醛都能与金属钠发生反应 | |
| C. | 乙醇醛的一种同分异构体可以与NaHCO3溶液反应 | |
| D. | 等物质的量的乙醇与乙醇醛分别完全燃烧,消耗O2的物质的量之比为3:2 |
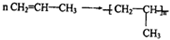
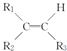 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$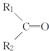 +R3-COOH,
+R3-COOH,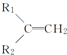 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$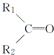 +CO2
+CO2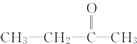 ),则此烯烃的结构简式是CH2=C(CH3)C2H5.
),则此烯烃的结构简式是CH2=C(CH3)C2H5.