题目内容
19.阿伏加德罗常数的值为6.02×1023mol-1,下列说法中正确的是( )| A. | 0.5 L 1 mol•L-1 MgCl2溶液中含有的Cl-数目为0.5×6.02×1023 | |
| B. | 在0℃、101kPa时,22.4 L H2中含有6.02×1023个氢原子 | |
| C. | 14 g N2中含有6.02×1023个原子 | |
| D. | 6.02×1023个CO2分子与0.5 mol CH4的质量比为7:4 |
分析 A、求出氯化镁的物质的量,然后根据1mol氯化镁中含2mol氯离子来分析;
B、求出氢气的物质的量,然后根据氢气为双原子分子来分析;
C、氮气由氮原子构成;
D、根据分子个数求出二氧化碳的物质的量和质量,并求出甲烷的质量.
解答 解:A、溶液中氯化镁的物质的量n=CV=1mol/L×0.5L=0.5mol,而1mol氯化镁中含2mol氯离子,故0.5mol氯化镁中含NA个氯离子,故A错误;
B、标况下22.4L氢气的物质的量为1mol,而氢气为双原子分子,故1mol氢气中含2NA个氢原子,故B错误;
C、氮气由氮原子构成,故14g氮气中含有的氮原子的物质的量为1mol,个数为NA个,故C正确;
D、NA个二氧化碳分子个的物质的量为1mol,质量为44g,而0.5mol甲烷的质量为8g,故两者的质量之比为11;2,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.碱性电池具有容量大,放电电流大的特点,因而得到广泛的应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:Zn+2MnO2+2H2O═Zn(OH)2+MnOOH,下列说法不正确的是( )
| A. | 电池工作时锌为负极 | |
| B. | 电池正极的电极反应式为:2MnO2+2H2O+2e-═2MnOOH+2OH- | |
| C. | 电池工作时,电解液的OH-移向正极 | |
| D. | 外电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
7.属于芳香族,且苯环上一氯代物有4种的是( )
| A. | CH2=CH-CH=CH2 | B. | CH3CH=CH2 | C. |  | D. |  2-甲基丁烷 2-甲基丁烷 |
14.下列各组数据中,前者刚好是后者两倍的是( )
| A. | 2 mol H2O的摩尔质量和1mol H2O的摩尔质量 | |
| B. | 200 mL 1 mol•L-1氯化钙溶液中c(Cl-)和100 mL 2 mol•L-1氯化钾溶液中c(Cl-) | |
| C. | 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数 | |
| D. | 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度 |
11.从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A. | CuSO4是氧化剂,FeS2既是氧化剂又是还原剂 | |
| B. | 当生成7molCu2S时,共转移电子14mol | |
| C. | 产物中的SO42-离子全部是氧化产物 | |
| D. | 该反应中氧化剂、还原剂的物质的量之比为14:5 |
8.去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法正确的是( )
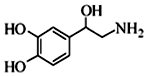

| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有8种氢原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
 其中:a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物.
其中:a是单质,b是气体,c、d是氧化物,e是最高价氧化物对应的水化物.