题目内容
某实验小组的同学为探究Na2O2与SO2的反应,用如图1所示装置进行实验.通入SO2气体后,将带火星的木条插入试管C中,木条复燃.
请回答下列问题:
(1)A装置中浓硫酸的作用是 .
(2)部分同学依据Na2O2和CO2的反应,用类比的方法推理Na2O2与SO2反应的固体产物为 .另一部分同学依据SO2的强还原性和Na2O2的强氧化性,猜想产物中含有Na2SO4.为检验生成物中是否存在Na2SO4,他们设计了如下实验方案:
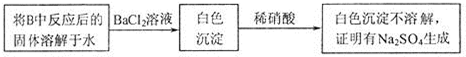
请判断上述方案是否合理 ,简要说明理由: .
(3)向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,请分析通入SO2物质的量与溶液中溶质组成的关系,填写下表空格.
请在图2中画出溶液中溶质的总质量随缓慢通入SO2物质的量的变化曲线.(作图时请在起点、拐点和终点注明坐标)
请回答下列问题:
(1)A装置中浓硫酸的作用是
(2)部分同学依据Na2O2和CO2的反应,用类比的方法推理Na2O2与SO2反应的固体产物为

请判断上述方案是否合理
(3)向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,请分析通入SO2物质的量与溶液中溶质组成的关系,填写下表空格.
| n(SO2)的范围 | 1mol溶液中溶质的化学式 |
| (0,0.5) | |
| Na2SO3、NaHSO3 |

考点:二氧化硫的化学性质,钠的重要化合物
专题:实验题
分析:(1)水能与过氧化钠反应,则浓硫酸可干燥气体,防止水参加反应;
(2)依据Na2O2和CO2的反应,Na2O2与SO2反应生了Na2SO3和O2;硫酸钠和亚硫酸钠均有氯化钡反应生成沉淀,亚硫酸钡加硝酸时氧化生成硫酸钡,不能说明是否含硫酸钡;
(3)根据向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,发生的反应应该为①2NaOH+SO2═Na2SO3+H2O,②Na2SO3+H2O+SO2═2NaHSO3,当n(SO2)在(0,0.5)时只发生反应①,并且氢氧化钠过量;当生成 Na2SO3、NaHSO3时发生反应①和②,则n(SO2)在(0.5,1),据此分析.
(2)依据Na2O2和CO2的反应,Na2O2与SO2反应生了Na2SO3和O2;硫酸钠和亚硫酸钠均有氯化钡反应生成沉淀,亚硫酸钡加硝酸时氧化生成硫酸钡,不能说明是否含硫酸钡;
(3)根据向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,发生的反应应该为①2NaOH+SO2═Na2SO3+H2O,②Na2SO3+H2O+SO2═2NaHSO3,当n(SO2)在(0,0.5)时只发生反应①,并且氢氧化钠过量;当生成 Na2SO3、NaHSO3时发生反应①和②,则n(SO2)在(0.5,1),据此分析.
解答:
解:(1)水能与过氧化钠反应,则浓硫酸可干燥气体,防止水参加反应,所以A中浓硫酸作用为干燥SO2;故答案为:干燥SO2;
(2)依据Na2O2和CO2的反应,Na2O2与SO2反应生了Na2SO3和O2,反应为2Na2O2+2SO2═2Na2SO3+O2,由实验流程可知,如果反应装置B中Na2O2过量,它将会氧化Na2SO3或稀硝酸具有强氧化性,它也会氧化Na2SO3,最终都生成硫酸钡沉淀,则实验设计不合理,
故答案为:Na2SO3;不合理;如果反应装置B中Na2O2过量,它将会氧化Na2SO3或稀硝酸具有强氧化性,它也会氧化Na2SO3;
(3)向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,发生的反应应该为①2NaOH+SO2═Na2SO3+H2O,②Na2SO3+H2O+SO2═2NaHSO3,当n(SO2)在(0,0.5)时只发生反应①,并且氢氧化钠过量;当生成 Na2SO3、NaHSO3时发生反应①和②,则n(SO2)在(0.5,1);开始n(SO2)=0时,即溶质的总质量为1L×1.0mol/L×40g/mol=40g,当n(SO2)=0.5mol时,刚好生成0.5mol亚硫酸钠,则质量为0.5×126=63g,当n(SO2)=1mol时,刚好生成1mol亚硫酸氢钠,则质量为1×104=104g,
所以图象为: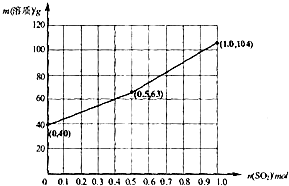 ,故答案为:NaOH、Na2SO3;(0.5,1);
,故答案为:NaOH、Na2SO3;(0.5,1); ;
;
(2)依据Na2O2和CO2的反应,Na2O2与SO2反应生了Na2SO3和O2,反应为2Na2O2+2SO2═2Na2SO3+O2,由实验流程可知,如果反应装置B中Na2O2过量,它将会氧化Na2SO3或稀硝酸具有强氧化性,它也会氧化Na2SO3,最终都生成硫酸钡沉淀,则实验设计不合理,
故答案为:Na2SO3;不合理;如果反应装置B中Na2O2过量,它将会氧化Na2SO3或稀硝酸具有强氧化性,它也会氧化Na2SO3;
(3)向1L1.0mol/LNaOH溶液中缓慢通入1.0molSO2气体,发生的反应应该为①2NaOH+SO2═Na2SO3+H2O,②Na2SO3+H2O+SO2═2NaHSO3,当n(SO2)在(0,0.5)时只发生反应①,并且氢氧化钠过量;当生成 Na2SO3、NaHSO3时发生反应①和②,则n(SO2)在(0.5,1);开始n(SO2)=0时,即溶质的总质量为1L×1.0mol/L×40g/mol=40g,当n(SO2)=0.5mol时,刚好生成0.5mol亚硫酸钠,则质量为0.5×126=63g,当n(SO2)=1mol时,刚好生成1mol亚硫酸氢钠,则质量为1×104=104g,
所以图象为:
 ,故答案为:NaOH、Na2SO3;(0.5,1);
,故答案为:NaOH、Na2SO3;(0.5,1); ;
;
点评:本题考查性质实验方案的设计以及二氧化硫与氢氧化钠反应量的关系及其计算,综合考查物质的性质及实验能力、计算能力,为高频考点,把握二氧化硫、过氧化钠及硝酸的性质及实验流程为解答的关键,题目难度不大.

练习册系列答案
相关题目
在强酸性溶液中,可以大量共存的离子组是( )
| A、Na+、K+、CH3COO-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Na+、Ag+、SO42-、Cl- |
| D、Al3+、Fe3+、NO3-、SO42- |
不能由单质直接化合而得到的化合物有( )
| A、Al2S3 |
| B、FeS |
| C、CuS |
| D、FeCl3 |
臭氧(O3)氧化性很强,下列物质:(1)SO2;(2)CO2;(3)CO;(4)N2;(5)氟里昂(CCl2F2);(6)NO中,能破坏大气臭氧层的是( )
| A、(1)(3)(5) |
| B、(1)(3)(5)(6) |
| C、(1)(2)(3)(5(6) |
| D、全部 |
相同体积的氯化钠、氯化镁、氯化铝溶液分别与过量的硝酸银溶液反应,所生成的沉淀物质的量相同,则原氯化钠、氯化镁、氯化铝溶液的物质的量浓度之比为( )
| A、1:2:3 |
| B、3:2:1 |
| C、6:3:1 |
| D、6:3:2 |
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、标准状况下4.48LH2O的分子个数为2NA |
| B、22克CO2的分子个数为0.5NA |
| C、1L浓度为0.1mol/L的MgCl2溶液中Cl-为0.1NA |
| D、标准状况下2.24LNO2中原子个数为0.2NA |

 在一定条件下容易发生“脱羧”反应,产物之一为甲醛的同系物,写出该产物的结构简式:
在一定条件下容易发生“脱羧”反应,产物之一为甲醛的同系物,写出该产物的结构简式: