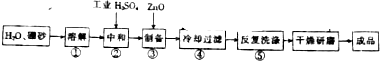
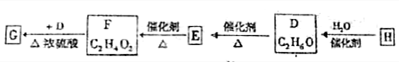
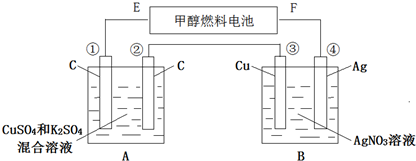
题目内容
19.某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时0.2mol/L Ba(OH)2溶液中的pH=13.分析 某温度下,纯水中的c(H+)=2.0×10-7mol/L,纯水中的c(OH-)=2.0×10-7mol/L,则该温度下Kw=c(H+).c(OH-)=4.0×10-14,0.2mol/LBa(OH)2溶液中c(OH-)=2c[Ba(OH)2]=0.2mol/L×2=0.4mol/L,先计算溶液中c(H+),再根据pH=-lgc(H+)计算.
解答 解:某温度下,纯水中的c(H+)=2.0×10-7mol/L,纯水中的c(OH-)=2.0×10-7mol/L,则该温度下Kw=c(H+).c(OH-)=4.0×10-14,0.2mol/LBa(OH)2溶液中c(OH-)=2c[Ba(OH)2]=0.2mol/L×2=0.4mol/L,溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{4.0×1{0}^{-14}}{0.4}$mol/L=1.0×10-13,则pH=-lgc(H+)=-lg1.0×10-13
=13,故答案为:13.
点评 本题考查溶液pH的计算,为高频考点,正确计算溶液中离子积常数是解本题关键,注意c(OH-)、c[Ba(OH)2]的关系,侧重考查学生分析计算能力,题目难度不大.

练习册系列答案
相关题目
9.下列关于有机物的说法正确的是( )
| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 丁烷的沸点低于丙醇 | |
| D. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 |
7.下列有关化学术语或物质变化的说法不正确的是( )
| A. | Na+的结构示意图为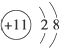 | |
| B. | 明矾的化学式为KAl(SO4)2•12H2O | |
| C. | 某微粒的电子数等于质子数,则该微粒可能是分子或离子 | |
| D. | 化学变化不产生新元素,产生新元素的变化不是化学变化 |
4.分子式为C10H14的芳香烃中,苯环上一溴代物有两种结构的物质共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |