题目内容
17.甲烷-空气燃料电池(以KOH溶液为电解质)的工作原理如图所示.放电过程中,电流由铜极流向铂极.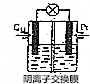
①负极是铂,电极反应式为CH4-8e-+10OH-═CO32-+7H2O;
②若电路上通过4mol电子,理论上消耗22.4L O2(标准状况).
③电池放电过程中,OH-由阴离子交换膜左侧向右侧迁移(填“”或“右”).
分析 原电池工作时,电子从负极流出,经导线流向正极,电流与电子流向相反,已知电流由铜极流向铂极,则铜作正极,铂作负极,甲烷作燃料在负极失电子被氧化成二氧化碳,二氧化碳与电解质氢氧化钾溶液发生反应,生成二氧化碳和水,电极反应为:CH4-8e-+10OH-═CO32-+7H2O,氧气在正极得电子发生还原反应:O2+4e-+2H2O═4OH-,在电解质溶液中,阴离子移向负极,以此解答该题.
解答 解:①原电池工作时,电子从负极流出,经导线流向正极,电流与电子流向相反,已知电流由铜极流向铂极,则铜作正极,铂作负极,甲烷作燃料在负极失电子被氧化成二氧化碳,二氧化碳与电解质氢氧化钾溶液发生反应,生成二氧化碳和水,电极反应为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:铂;CH4-8e-+10OH-═CO32-+7H2O;
②氧气在正极得电子发生还原反应:O2+4e-+2H2O═4OH-,则电路上通过4mol电子时,消耗1mol O2,标况下的体积为22.4L,
故答案为:22.4;
③在电解质溶液中,阴离子交换膜只允许阴离子通过,则阴离子OH-移向负极,即从左侧移向右侧,
故答案为:左;右.
点评 本题考查原电池知识,为高频考点,注意在燃料电池中燃料负极上失电子发生氧化反应,氧化剂在正极上得电子发生还原反应,答题时注意在碱性介质中的电极反应式,难度不大.

练习册系列答案
相关题目
7.下列关于化学反应与能量变化的说法正确的是( )
| A. | 放热反应的发生无需任何条件 | |
| B. | 化学键断裂吸收能量,化学键形成放出能量 | |
| C. | 化学反应过程中的能量变化都是热量变化 | |
| D. | 只有化学反应过程中才有能量变化 |
8.下列说法正确的是( )
| A. | 分子式为C4H10O的醇,能在铜催化和加热条件下被氧气氧化为醛的同分异构体共有4种 | |
| B. | 2-氯丁烷与NaOH乙醇的溶液共热的反应产物中一定不存在同分异构体 | |
| C. | 3-甲基-3-乙基戊烷的一氯代物有5种 | |
| D. | 分子式为C7H8O的有机物,能与氯化铁溶液发生显色反应的同分异构体共有3种 |
5.已知放射性元素${\;}_{77}^{192}$Ir位于元素周期表中第六周期第Ⅷ族,下列关于${\;}_{77}^{192}$Ir的说法正确的是( )
| A. | 铱为非金属元素 | |
| B. | ${\;}_{77}^{192}$Ir中子数与质子数的差为38 | |
| C. | 铱元素与碘元素位于同一周期 | |
| D. | ${\;}_{77}^{192}$Ir核外含有115个电子 |
2.下列说法正确的是( )
| A. | 一定量(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH${\;}_{4}^{+}$)>2c(SO${\;}_{4}^{2-}$) | |
| B. | 向25mL0.1mol/L的溶液①氨水 ②NH4Cl溶液分别加入25mL0.1mol/L盐酸后,溶液中c(NH${\;}_{4}^{+}$):①>② | |
| C. | 将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol/L的KHA溶液,其pH=10:c(K+)>c(A2-)>c(HA-)>c(OH-) |
1.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1 mol Cl2与足量Fe反应,转移的电子数为3NA | |
| B. | 常温下,500mL 2mol•L-1的Na2CO3溶液中含Na+数目为2NA | |
| C. | 1.8gNH4+的离子中含有的质子数为0.1NA | |
| D. | 标准状况下,1 L水所含分子数为NA |
18.下列说法正确的是( )
| A. | 植物油的主要成分是高级脂肪酸 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 | |
| D. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
19.回归、改进、拓展教材实验,是高考化学实验考查的常见形式.
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑.
(2)①该催化剂中铁元素的化合价为+3.
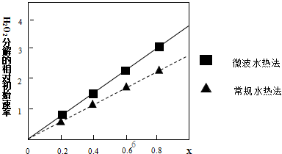
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是Co2+.
II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
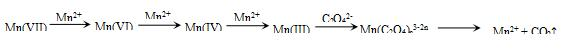
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶
(4)完成探究,记录数据
仔细阅读分析表中数据,回答问题:
x=25mL,假设2成立(填“1”、“2”或“3”)
I.甲组同学在进行《必修二》实验2-5“Fe3+离子在H2O2溶液分解实验中的催化作用”时,进行了以下探究.基于目前学过的元素周期表的相关知识,该小组推测了同为第四周期第VIII族的Fe、Co、Ni可能有相似的催化机理.
【查阅资料】:钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.其中CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)也可用作H2O2分解的催化剂,具有较高的活性.
(1)写出H2O2溶液在Fe3+催化下分解的化学方程式2H2O2$\frac{\underline{\;三价铁离子\;}}{\;}$2H2O+O2↑.
(2)①该催化剂中铁元素的化合价为+3.
②如图表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:微波水热法制取得到的催化剂活性更高,由此推测Co2+、Ni2+两种离子中催化效果更好的是Co2+.

II.乙组同学在进行《选修四》实验2-2“草酸溶液浓度对酸性高锰酸钾溶液褪色时间的影响”时,发现溶液褪色总是先慢后快,该小组设计了如下过程探究其原因:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为(流程中“III”等为Mn的价态):
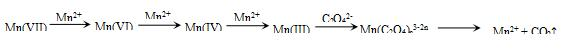
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
【设计、完成实验】
(3)称取6.3g草酸晶体(H2C2O4•2H2O),配制500mL 0.10mol/L H2C2O4溶液.在上述过程中必须用到的2种定量仪器是托盘天平和500mL容量瓶
(4)完成探究,记录数据
| 实验 编号 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
| 0.10 mol/L H2C2O4溶液 | 等浓度 KMnO4溶液 | H2O | 0.50 mol/L 稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | \ | 18 |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度65℃ | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
| 4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/L K2SO4溶液 | 18 |
x=25mL,假设2成立(填“1”、“2”或“3”)
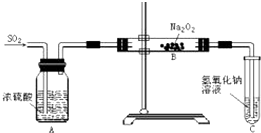 有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.
有两个实验小组的同学为探究过氧化钠与二氧化硫反应,都用如图所示的装置进行实验.通入SO2气体,将带余烬的木条插入试管C中,木条复燃.