题目内容
5.海水中蕴藏着丰富的资源.除从海水中可制得食盐外,还可以制取镁、钾、溴及其化工产品.从海水中制取金属镁、溴的化工流程图如图:
已知:MgO的熔点为2800℃,MgCl2的熔点为712℃.
回答下列问题:
(1)操作2的方法是过滤,操作3具体指蒸发浓缩、降温结晶.
(2)操作1粗盐精制主要是要除掉粗盐中的Ca2+、Mg2+、SO42-离子,以下试剂合理的组合是c
①稀盐酸 ②NaOH ③Na2CO3 ④BaCl2
a.②③④①b.③②④①c.④②③①d.④③①②
(3)SO2水溶液可以起到富集溴的目的,该溶液吸收溴的离子反应方程式是Br2+SO2+2H2O═2Br-+SO42-+4H+.
(4)写出电解MgCl2制取Mg的化学方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(5)有同学认为:上述流程过于复杂,可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制取金属镁,这样可简化实验步骤,体现实验的简约性原则.你同意该同学的想法吗?不同意(填“同意”或“不同意”),请说出你同意或不同意的理由MgO熔点远高于MgCl2,电解熔融MgO耗费大量的能量.
分析 海水晒盐得到卤水和粗盐,粗盐经过精制提纯得到精盐,卤水中加入熟石灰沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁沉淀和滤液,氢氧化镁加入稀盐酸溶解得到氯化镁溶液,蒸发浓缩、冷却结晶、过滤洗涤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到固体氯化镁,电解熔融氯化镁得到金属镁,滤液中通入氯气氧化溴离子得到溴单质,溴单质被二氧化硫吸收生成溴化氢,再通入氯气氧化溴离子生成溴单质,起到富集溴的作用,
(1)分析可知操作2的方法是分离固体和溶液用过滤方法,操作3是溶液中得到溶质固体,利用蒸发浓缩、冷却结晶、过滤洗涤等操作得到;
(2)NaCl溶液中混有的Ca2+、Mg2+、SO42-,应该先加入氢氧化钠,然后加入氯化钡,再加入碳酸钠,最后加热盐酸;加入的每种试剂必须过量,保证将所有杂质都能除去,反应完采用加热方法,除去剩余的氯化氢;
(3)SO2水溶液可以起到富集溴的目的,吸收溴单质发生氧化还原反应生成硫酸和溴化氢;
(4)电解熔融MgCl2制取Mg和氯气;
(5)MgO熔点远高于MgCl2,应注意节约能源.
解答 解:(1)分析可知操作2的方法是分离固体和溶液用过滤方法,操作3是溶液中得到溶质固体,利用蒸发浓缩、冷却结晶、过滤洗涤等操作得到,
故答案为:过滤; 蒸发浓缩 降温结晶;
(2)先加入足量的②NaOH,除去镁离子;然后加入过量④BaCl2,除去SO42-;再加入过量③Na2CO3 除去Ca2+及过量的Ba2+,过滤后,滤液中加入过量的①盐酸,除去溶液中剩余的碳酸根和氢氧化钠中的氢氧根,最后加热除去剩余的氯化氢.
故合理顺序是:④②③①或②④③①,
故答案为:c;
(3)SO2水溶液可以起到富集溴的目的,吸收溴单质发生氧化还原反应生成硫酸和溴化氢,反应的离子方程式为:Br2+SO2+2H2O═2Br-+SO42-+4H+,
故答案为:Br2+SO2+2H2O═2Br-+SO42-+4H+;
(4)电解熔融氯化镁生成氯气和镁,反应的化学方程式为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,
故答案为:MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
(5)MgO熔点远高于MgCl2,电解熔融MgO耗费大量的能量,不同意该同学的想法,应注意节约能源,可用氯化镁代替,
故答案为:不同意;MgO熔点远高于MgCl2,电解熔融MgO耗费大量的能量.
点评 本题考查物质的分离、提纯,涉及电解池原理的分析判断,注意离子方程式书写和实验基本操作的理解应用,掌握基础,仔细审题是解题关键,题目难度中等.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | CH3CH3→CH3CH2Cl 取代反应 | B. | CH2═CH2→CH3CH2OH 取代反应 | ||
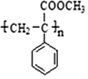
| C. | CH2═CH2→CH2BrCH2Br 加成反应 | D. |  取代反应 取代反应 |
| A. | 碳酸钠的水解反应:CO32-+H3O+?HCO3-+H2O | |
| B. | 氢氧化铁胶体的制备:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | 偏铝酸钠中滴加碳酸氢钠溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| D. | 碱性氢氧燃料电池的正极反应式:4OH--4e-═2H2O+O2↑ |
| A. | MnCO3 | B. | MnO2 | C. | Na2CO3 | D. | 氨水 |
| A. | A的平均反应速率为0.1mol/(L•min) | |
| B. | 平衡时,B的转化率为20% | |
| C. | 平衡时,C的浓度为0.125 mol/L | |
| D. | 平衡时,容器内的压强为原来的0.875倍 |
| A. | 从锂到铯与水反应越来越剧烈 | B. | 液态钠可用作核反应堆的传热介质 | ||
| C. | Li在氧气中燃烧生成Li2O2 | D. | 氢氧化铯的碱性强于氢氧化钠 |
 如图为氢氧燃料电池装置示意图.
如图为氢氧燃料电池装置示意图. )有如下转化关系:
)有如下转化关系:
 .
. .
. .
.