题目内容
4.在中和滴定中,稀盐酸是常用的滴定剂,而盐酸标准溶液的浓度又常常是以氢氧化钠作基准物质标定的,某学生为此进行如下操作:a.用蒸馏水分别洗净酸式滴定管和锥形瓶,并排出滴定管尖嘴部位的气泡;
b.用待标定盐酸润洗滴定管内壁3次(每次用量2~3mL);
c.向滴定管内注入待标定盐酸,记录管内液面所在刻度V1 mL;
d.将准确称取的W g干燥的NaOH放入锥形瓶中,加25mL蒸馏水,振荡使之溶解;
e.滴入1滴酚酞指示剂;
f.在锥形瓶下铺一张白纸,向瓶内滴加待标定的盐酸,边滴边摇动锥形瓶,直到溶液的红色刚好褪去,并不再变红,即为滴定终点;
g.记录滴定管内液面所在刻度V2 mL.
(1)若该生操作无误,则所标定盐酸的物质的量浓度为$\frac{25w}{V{\;}_{2}-V{\;}_{1}}$mol/L.
(2)在进行滴定操作时,操作者的眼睛应注视锥形瓶中溶液的颜色变化.
(3)若该生在溶解固体氢氧化钠时,用了28mL蒸馏水,则所标定盐酸的浓度值将无影响(填“偏高”、“偏低”、“无影响”).
(4)若该生记录滴定管内液面所在刻度时,滴定前是仰视读数,达滴定终点是平视读数,则所标定盐酸的浓度值将偏高(填“偏高”、“降低”、“无影响”).
分析 (1)根据关系式HCl~NaOH来计算出盐酸的浓度;
(2)实验中应注意观察锥形瓶中溶液颜色的变化;
(3-4)根据关系式HCl~NaOH,则利用c(HCl)=$\frac{n(NaOH)}{V(HCl)}$分析.
解答 解:(1)HCl~NaOH
1 1
c(HCl)×(V2-V1)×10-3L $\frac{wg}{40g/mol}$;
解得:c(HCl)=$\frac{25w}{V{\;}_{2}-V{\;}_{1}}$mol/L,
故答案为:$\frac{25w}{V{\;}_{2}-V{\;}_{1}}$mol/L;
(2)滴定时,滴定过程中,两眼应该注视锥形瓶内溶液的颜色变化,以判断滴定终点;故答案为:锥形瓶中溶液的颜色变化;
(3)若该生在溶解固体氢氧化钠时,用了28mL蒸馏水,但NaOH的物质的量不变,所以根据HCl~NaOH,c(HCl)=$\frac{n(NaOH)}{V(HCl)}$,则所标定盐酸的浓度值将无影响,故答案为:无影响;
(4)滴定前是仰视读数,达滴定终点是平视读数,消耗的盐酸液的体积偏小,所以根据HCl~NaOH,c(HCl)=$\frac{n(NaOH)}{V(HCl)}$分析,可知c(待测)偏高,故答案为:偏高.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的步骤、方法以及注意事项,在误差分析时根据c(HCl)=$\frac{n(NaOH)}{V(HCl)}$分析即可.

练习册系列答案
相关题目
13.伞形酮可由雷琐苯乙酮和苹果酸在一定条件下反应制得,下列说法错误的是( )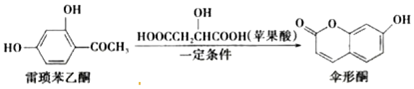

| A. | 雷琐苯乙酮有两种含氧官能团 | |
| B. | 1 mol伞形酮与足量 NaOH溶液反应,最多可消耗 2 mol NaOH | |
| C. | 伞形酮难溶于水 | |
| D. | 雷琐苯乙酮和伞形酮都能跟 FeCl3溶液发生显色反应 |
14.某溶液中含有四种离子,已知其中三种离子Na+、Mg2+、NO3-的物质的量浓度分别为0.2mol•L-1,0.1mol•L-1,0.1mol•L-1,则溶液中另一离子及其物质的量浓度可能是( )
| A. | SO42- 0.1 mol•L-1 | B. | Al3+ 0.2 mol•L-1 | ||
| C. | Cl- 0.3 mol•L-1 | D. | K+ 0.4 mol•L-1 |
11.下列实验操作及数据记录正确的是( )
| A. | 用量筒量取KMnO4溶液12.00mL | |
| B. | 测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板 | |
| C. | 常温下,测得0.01mol/LNaHCO3溶液的pH值=12 | |
| D. | 加热蒸发FeCl3溶液,获得FeCl3固体 |
18.下列说法正确的是( )
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
9.下列与滴定实验有关的说法中正确的是( )
| A. | 用碱式滴定管准确量取20.00 mL的高锰酸钾溶液 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用NaOH滴定盐酸时,只能用酚酞作指示剂 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
16.在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10mol•L-1的高锰酸钾溶液500mL.
步骤二:取0.02mol•L-1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需.
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A、滴定管滴定前有气泡,滴定后气泡消失 B、锥形瓶洗涤后没有干燥
C、滴定终点时,读数时俯视 D、滴定时锥形瓶中有液体溅出
E、一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为mol•L-1.
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10mol•L-1的高锰酸钾溶液500mL.
步骤二:取0.02mol•L-1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
| 平行实验编号 | Na2C2O4溶液 (mL) | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
| 1 | 20.00 | 0.00 | 21.18 |
| 2 | 20.00 | 1.02 | 21.00 |
| 3 | 20.00 | 1.18 | 21.20 |
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需.
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A、滴定管滴定前有气泡,滴定后气泡消失 B、锥形瓶洗涤后没有干燥
C、滴定终点时,读数时俯视 D、滴定时锥形瓶中有液体溅出
E、一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为mol•L-1.
14.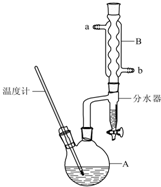 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)O+H2O 反应物和生成物的相关数据如下:
合成反应:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水,20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g.
回答下列问题:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,采用分水器除了可以提高正丁醇的利用率,还可以起到不断分离出水,促使平衡正向移动作用(根据有关化学理论回答).
(4)步骤③的目的是初步洗去浓硫酸,振摇后静置,粗产物应在分液漏斗的上(填“上”或“下”)口分离出.
(5)若温度过高会发生副反应生成烯烃,可能的反应方程式为CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$ CH3CH2CH=CH2↑+H2O.
(6)步骤⑤中,加热蒸馏时应收集142℃左右的馏分.本实验中,正丁醚的产率为40.0%.
 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)O+H2O 反应物和生成物的相关数据如下:
| 相对分子质量 | 沸点/℃ | 密度/g•cm3 | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水,20mLNaOH溶液和40mL水洗涤,分液后加入约3g无水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚13g.
回答下列问题:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)加热A前,需先从b(填“a”或“b”)口向B中通入水.
(3)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,采用分水器除了可以提高正丁醇的利用率,还可以起到不断分离出水,促使平衡正向移动作用(根据有关化学理论回答).
(4)步骤③的目的是初步洗去浓硫酸,振摇后静置,粗产物应在分液漏斗的上(填“上”或“下”)口分离出.
(5)若温度过高会发生副反应生成烯烃,可能的反应方程式为CH3CH2CH2CH2OH$→_{△}^{浓硫酸}$ CH3CH2CH=CH2↑+H2O.
(6)步骤⑤中,加热蒸馏时应收集142℃左右的馏分.本实验中,正丁醚的产率为40.0%.