题目内容
4.在一恒容密闭容器中通入amol A、bmol B发生反应aA(g)+bB(g)?cC(g),达到平衡后,改变下列条件,分析转化率的变化情况(用“增大”、“减小”或“不变”表示).①再通入bmol B,α(A)增大,α(B)减小.
②再通入amol A、bmol B,若a+b>c,α(A)增大、α(B)增大;
若a+b=c,α(A)不变、α(B)不变;若a+b<c,α(A)减小、α(B)减小.
分析 ①恒容再通入bmol B,平衡正向移动,促进A的转化;
②再通入amol A、bmol B,若a+b>c,压强增大,平衡正向移动;
若a+b=c,平衡不移动;
若a+b<c,平衡逆向移动.
解答 解:①恒容再通入bmol B,平衡正向移动,促进A的转化,则α(A)增大,α(B)减小,故答案为:增大;减小;
②再通入amol A、bmol B,若a+b>c,压强增大,平衡正向移动,则α(A)增大、α(B)增大;
若a+b=c,平衡不移动,则α(A)不变、α(B)不变;
若a+b<c,平衡逆向移动,则α(A)减小、α(B)减小,
故答案为:增大;增大;不变;不变;减小;减小.
点评 本题考查化学平衡移动,为高频考点,把握压强、浓度对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意化学计量数的关系,题目难度不大.

练习册系列答案
相关题目
10.下列离子方程式书写不正确的是( )
| A. | 二氧化硅与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 碳酸钡溶于稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3↓ |
11.下列实验设计及其对应的离子方程式均正确的是( )
| A. | 用铜电极电解Na C l溶液制备Cl2:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| B. | 向MgCl2溶液中加入氨水制备Mg(OH)2:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 将Fe S溶于稀硝酸制备Fe(NO3)3:FeS+4 H++NO3═Fe3++NO↑+S↓+2H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6 H++5 H2O2═2Mn2++5O2↑+8H2O |
8.可以进行烘干操作的仪器是( )
| A. | 量筒 | B. | 锥形瓶 | C. | 容量瓶 | D. | 滴定管 |
15.只用组内溶液相互混合就能鉴别的组别是( )
| A. | Na2SO4、BaCl2、KNO3、NaCl | B. | NaCl、AgNO3、NaNO3、HCl | ||
| C. | NaOH、Na2SO4、FeCl3、MgCl2 | D. | Na2SO4、NaNO3、CaCl2、NaCl |
 只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能.请认真观察图,然后回答相关问题.
只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能.请认真观察图,然后回答相关问题.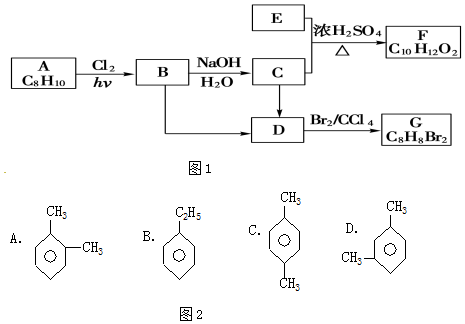
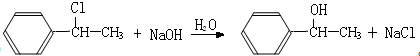 ;
; ;
;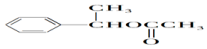 ;
; (结构简式).
(结构简式).