题目内容
13.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2取1.55 g该固体恰好与10 mL 4mol•L-1硝酸完全反应.所得溶液仅为Mg(NO3)2溶液.则x值为( )| A. | 1 | B. | 2 | C. | 3 | D. | 5 |
分析 所得溶液仅为Mg(NO3)2溶液可知,Mg(1+x)(CO3)x(OH)2~2(1+x)HNO3,结合n=$\frac{m}{M}$、n=cV计算.
解答 解:所得溶液仅为Mg(NO3)2溶液可知,则
Mg(1+x)(CO3)x(OH)2~2(1+x)HNO3,
1 2(1+x)
$\frac{1.55g}{(24+24x+60x+34)g/mol}$ 0.01L×4mol/L
2(1+x)×$\frac{1.55g}{(24+24x+60x+34)g/mol}$=0.01L×4mol/L
解得x=3,
故选C.
点评 本题考查化学反应的计算,为高频考点,把握硝酸镁的构成及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意关系式法的应用,题目难度不大.

练习册系列答案
相关题目
19.向CuSO4溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色,再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.下列有关分析中正确的是( )
| A. | 上述实验条件下,物质的氧化性:Cu>SO2>I2 | |
| B. | 在SO2与I2反应中得到的还原产物为H2SO4 | |
| C. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 | |
| D. | 滴加KI溶液时.每转移2mole-会生成2molCuI沉淀 |
1.下列各步制取物质,最终无法达到目的有( )
| A. | Al$→_{△}^{O_{2}}$Al2O3 $\stackrel{HNO_{3}}{→}$Al(NO3)3$→_{△}^{蒸干、灼烧}$Al2O3 | |
| B. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀硫酸}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| C. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| D. | FeSO4溶液$\stackrel{H_{2}S}{→}$FeS$\stackrel{过滤蒸干}{→}$FeS |
8.下列说法正确的是( )
| A. | 淀份与纤维素结构简式相同,互为同分异构体 | |
| B. | 聚乙烯、油脂、铜氨纤维、光导纤维都属于高分子 | |
| C. | 甲烷的二氯代物只有一种可证明甲烷为正四面体结构 | |
| D. | 蔗糖遇浓硫酸生碳化现象,但遇稀硫酸不会发生反应 |
18.下列说法正确的是( )
| A. | AlCl3溶液和Al2(SO4)3溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 | |
| B. | 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度 | |
| C. | 向CuCl2溶液中加入CuO,调节溶液的pH可除去溶液中混有的Fe3+ | |
| D. | 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝 |
5.下列各组离子在给定条件下一定能大量共存的是( )
| A. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 有大量NO3-存在的强酸性溶液中:NH4+、Na+、Fe3+、SO42- | |
| C. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Al3+、CH3COO-、I- | |
| D. | 能使pH试纸变蓝的溶液中:ClO-、S2-、Na+、K+ |
2.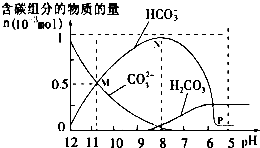 25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )
25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )
 25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )
25℃时在10mL0.10mol•L-1Na2CO3溶液中逐滴加入0.10mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示,下列说法正确的是( )| A. | pH=12的溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=7的溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(Cl-) | |
| C. | pH=8的溶液中:c(Na+)>c(HCO3-)>c(Cl-)>c(OH-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
3.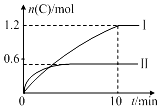 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )
 在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )
在2L的恒容密闭容器中充入A(g)和B(g),发生反应:A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1实验内容和结果分别如表和图所示.下列说法正确的是( )| 实验序号 | 温度 | 起始物质的量 | 热量变化 | |
| A | B | |||
| Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
| Ⅱ | 800℃ | 0.5 mol | 1.5 mol | -- |
| A. | a=160 | |
| B. | 600℃时,该反应的平衡常数是0.45 | |
| C. | 实验Ⅰ中,10 min内平均速率v(B)=0.06 mol•L-1•min-1 | |
| D. | 向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率不变 |