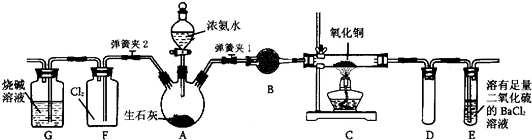
题目内容
5.按要求填空:(1)小苏打是某种治疗胃酸过多的胃药的主要成分,请写出该反应的离子方程式:HCO3-+H+=CO2↑+H2O.
(2)金属钠在氧气中充分燃烧,将所得产物投入水中,产物和迅速发生反应,写出该反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑.向所得溶液中加入FeSO4溶液,看到的现象是:生成白色沉淀,迅速变灰绿色,最后变红褐色,此过程中发生的氧化还原反应的化学方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(3)金属钙在一定条件下可以与氢气化合生成CaH2(白色固体).将该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红.请根据以上事实书写CaH2与水反应的化学方程式CaH2+2H2O=Ca(OH)2+2H2↑.
分析 (1)小苏打为NaHCO3,胃酸中含盐酸,二者反应生成氯化钠、水、二氧化碳;
(2)钠在空气中燃烧生成淡黄色的过氧化钠;过氧化钠和水反应生成氢氧化钠和氧气;
过氧化钠和水反应生成氢氧化钠,氢氧化钠和亚铁离子反应生成氢氧化亚铁白色沉淀,氢氧化亚铁易被氧化生成氢氧化铁红褐色沉淀,据此写出实验现象;有电子转移的化学反应是氧化还原反应;
(3)根据该白色固体加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红,说明有碱和气体生成,据此书写方程式.
解答 解:(1)小苏打为NaHCO3,胃酸中含盐酸,用小苏打治疗胃酸过多的离子反应为H++HCO3-=H2O+CO2↑,故答案为:HCO3-+H+=CO2↑+H2O;
(2)钠在空气中燃烧生成淡黄色固体过氧化钠;过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O═4NaOH+O2↑;
过氧化钠和水反应生成氢氧化钠,氢氧化钠和亚铁离子反应生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,极易被空气中的氧气氧化而迅速变灰绿色,最后变红褐色氢氧化铁沉淀,所以实验现象是:生成白色沉淀,迅速变灰绿色,最后变红褐色,氢氧化亚铁被氧化的反应是氧化还原反应,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3.
故答案为:2Na2O2+2H2O═4NaOH+O2↑;生成白色沉淀,迅速变灰绿色,最后变红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)因为CaH2加入滴有酚酞的蒸馏水中,可以观察到有气泡生成,溶液变红,说明有碱和气体生成,则方程式为:CaH2+2H2O=Ca(OH)2+2H2↑,
故答案为:CaH2+2H2O=Ca(OH)2+2H2↑.
点评 本题考查了钠的化合物的性质及氢氧化亚铁的性质等知识点,难度不大,注意:会用化学用语对实验现象进行描述,此点是高考的热点.

| A. | H2 | B. | CO2 | C. | SO2 | D. | CH4 |
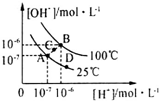
| A. | 图中A、B、D三点处Kw的大小关系:B>A>D | |
| B. | 25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3•H2O)的值逐渐减小 | |
| C. | 在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点 | |
| D. | 100℃时,0.05mol•L-1 H2SO4溶液的pH≠1 |
| A. | 等浓度时水溶液碱性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3>Na2CO3 | |
| C. | 与盐酸溶液反应的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等质量的Na2CO3、NaHCO3分别与足量的盐酸反应,NaHCO3产生的CO2多 |
| A. | Na2SO3溶液在空气中变质 | B. | 工业上炼铁 | ||
| C. | 二氧化硫的漂白原理 | D. | 将氯气通入冷的消石灰浊液中 |
| A. | 用氧化铝与水反应制取氢氧化铝 | B. | 氢氧化铝用于治疗胃酸过多 | ||
| C. | 氧化铁可用作红色颜料 | D. | 铁制容器可盛装烧碱溶液 |
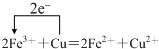 .
.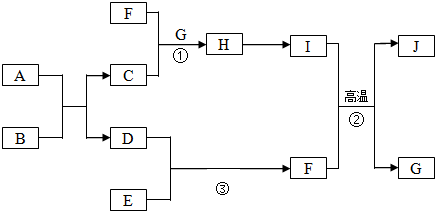
 ,B的名称是盐酸或硫酸.
,B的名称是盐酸或硫酸.