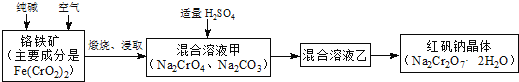
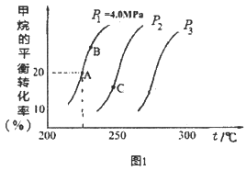
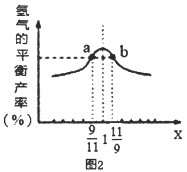
题目内容
【题目】二氧化氯(C1O2)易溶于水,是一种处理水的高效安全消毒剂。实验室以NH4C1、盐酸、NaClO2为原料制备C1O2的流程如下。已知NCl3晶体在95℃就会发生爆炸性分解,在热水中易分解,在空气中易挥发。下列说法错误的是( )

A.除去C1O2中的NH3可选用饱和食盐水
B.电解时,发生反应的化学方程式为NH4C1+2HCl![]() 3H2↑+NCl3
3H2↑+NCl3
C.X溶液中大量存在的离子是Na+、C1-、H+
D.为保证实验的安全,在电解时要控制好反应温度
【答案】AC
【解析】
A.氨气极易溶于水,但是二氧化氯也易溶于水,不能用饱和食盐水除去二氧化氯中的氨气,故A错误;
B.电解氯化铵和盐酸生成氢气和三氯化氮,方程方程式为:NH4C1+2HCl![]() 3H2↑+NCl3,故B正确;
3H2↑+NCl3,故B正确;
C.反应后的溶液应该显碱性,不会大量存在氢离子,故C错误;
D.已知NCl3晶体在95℃就会发生爆炸性分解,所以电解时要控制好温度,故D正确;
故选:AC。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目