题目内容
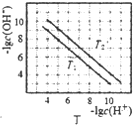
【题目】常温下,向20mL0.1molL-1的HA溶液中逐滴加入0.1molL-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是( )

A.从a到d,HA的电离始终受到促进
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9molL-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
【答案】B
【解析】
A.NaA水解促进水的电离,过量的NaOH存在抑制水的电离,从a到d,溶液中NaA不断增多,不断促进水的电离,故A正确;
B.c点存在NaA和HA,因为c点溶液为中性,pH=7,e点存在NaA和NaOH,则e点为碱性,pH>7,故B错误;
C.起始时溶液中只有HA,溶液为酸性,c水(H+)=10-11mol/L,则由HA电离出c(H+)=10-3mol/L,所以HA的电离平衡常数为Ka(HA)= ≈10-5,所以A-的水解常数为Kh=
≈10-5,所以A-的水解常数为Kh=![]() =10-9,故C正确;
=10-9,故C正确;
D.f点加入NaOH40mL,反应产生等量的NaOH和NaA,溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),存在物料守恒:c(Na+)=2c(A-)+2c(HA),则2c(HA)+c(A-)+c(H+)=c(OH-),故D正确,
故选:B。

【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
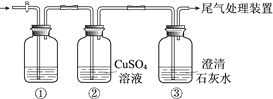
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C.实验Ⅰ①中发生的反应是:CO2+H2O+ S2== CO32+ H2S
D.由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱