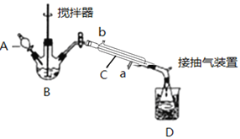
题目内容
【题目】合成气(CO+H2)可利用甲烷与水蒸气重整反应制得。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-242kJmol-1
O2(g)=H2O(g) △H1=-242kJmol-1
②2CO(g)+O2(g)=2CO2(g) △H2=-576kJmol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H3=-802.6KJmo1-1
则甲烷和水蒸气重整反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
CO(g)+3H2(g)△H4=____。该反应的活化能E1=240.1kJmol-1,则逆反应的活化能E2=____。
(2)重整反应中CH4的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图1所示。
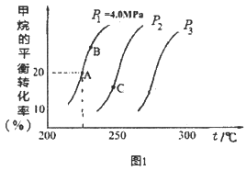
①图中A点的平衡常数KP=___(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),比较A、B、C三点的平衡常数Kp(A)、KP(B)、KP(C)由大到小的顺序为___。
②图中压强P1、P2、P3由大到小的顺序为___,理由是____。
(3)在恒容密闭容器中充入2mol的CH4和H2O(曲混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下测得H2平衡产率与x的关系如图2所示。请比较a、b两点CH4的转化率a点___b点(填“>”、“<”、“=”下同),a点c(CH4)___b点c[H2O(g)]。当x=1时,下列叙述正确的是____(填序号)。
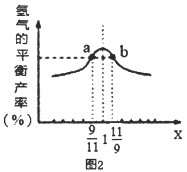
A.平衡常数K最大 B.CH4的转化率最大
C.氢气的产率最大 D.合成气的浓度最大
【答案】+211.4kJmol-1 28.7kJmol-1 ![]() Kp(C)>Kp(B)>Kp(A) P3>P2>P1 其他条件不变时,压强增大,平衡左移,甲烷的转化率减小 > = CD
Kp(C)>Kp(B)>Kp(A) P3>P2>P1 其他条件不变时,压强增大,平衡左移,甲烷的转化率减小 > = CD
【解析】
(1)根据盖斯定律计算;正反应为吸热反应,正反应活化能等于逆反应活化能与反应热之和;
(2)用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,平衡常数Kp等于生成物分压幂之积与反应物分压幂之积比值;
反应CH4(g)+H2O(g)CO(g)+3H2(g)为放热反应,温度越高,平衡常数越大;
②CH4(g)+H2O(g)CO(g)+3H2(g)是气体体积增大的反应,由图知温度不变时压强P1、P2、P3下甲烷转化率逐渐减小;
(3)两种反应物存在,增加其中一种反应物的量,能使另一种反应物的转化率提高。
(1)(1)已知:①H2(g)+O2(g)=H2O(g)△H1=-242kJmol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-576kJmol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H3=-802.6KJmo1-1
由③-①×3-②×得CH4(g)+H2O(g)CO(g)+3H2(g)△H4=△H3-△H1×3-△H2×=+211.4kJmol-1。
正反应活化能等于逆反应活化能与反应热之和,逆反应的活化能E2=E1-△H4=240.1kJmol-1-211.4kJmol-1=28.7kJmol-1,故答案为:+211.4kJmol-1;28.7kJmol-1;
(2)①假设甲烷有1mol,水蒸气有1mol,则

平衡后混合气体的总量:(0.8+0.8+0.2+0.6)mol=2.4mol,P(CH4)=P(H2O)=![]() ×4.0MPa=
×4.0MPa=![]() Mpa,P(CO)=
Mpa,P(CO)=![]() ×4.0MPa=
×4.0MPa=![]() Mpa,P(H2)=
Mpa,P(H2)=![]() ×4.0MPa=1Mpa,A点的平衡常数Kp=
×4.0MPa=1Mpa,A点的平衡常数Kp= ;
;
反应CH4(g)+H2O(g)CO(g)+3H2(g)为放热反应,温度升高,平衡右移,平衡常数增大,由图知,ABC三点温度依次升高,故平衡常数大小关系为Kp(C)>Kp(B)>Kp(A),
故答案为:![]() ;Kp(C)>Kp(B)>Kp(A);
;Kp(C)>Kp(B)>Kp(A);
②CH4(g)+H2O(g)CO(g)+3H2(g)是气体体积增大的反应,增大压强,平衡左移,甲烷转化率减小,由图知温度不变时压强P1、P2、P3下甲烷转化率逐渐减小,所以压强P1、P2、P3由大到小的顺序为P3>P2>P1,故答案为:P3>P2>P1;其他条件不变时,压强增大,平衡左移,甲烷的转化率减小;
(3)两种反应物存在,增加其中一种反应物的量,能使另一种反应物的转化率提高,a点H2O的含量相对较大,所以a点CH4的转化率更高;根据反应方程式分析,CH4和H2O是按照1:1反应的,a点CH4和
A.平衡常数K只与温度有关,温度不变,K不变,故A错误;
B.H2O(g)浓度越大,X越小,CH4的转化率越大,故C错误;
C.由图知当x=1时,氢气的产率最大,故C正确;
D.当x=1时,合成气的浓度最大,故D正确。故答案为:>;=;CD。

【题目】已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸 | CH3COOH | H2CO3 |
电离平衡常数(常温) | Ka=1.8×10-5 | Ka1=4.3×10-7; Ka2=5.6×10-11 |
下列判断正确的是
A. 向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C. NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D. 2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L