题目内容
7.已知有机物A~G之间存在如下转化关系,除D以外其他物质均为芳香族化合物,其中化合物B分子中含有一个甲基,化合物D完全燃烧生成等物质的量的CO2和H2O,且D蒸汽与氢气的相对密度为30.回答下列问题:

(1)D的化学名称为乙酸.
(2)①的反应类型为消去反应,②需要的试剂和反应条件是浓硫酸、加热.
(3)C中含氧官能团的名称为羟基,F的结构简式为C6H5CH=CH2.
(4)C+D一一E的化学方程式为
 +CH3COOH
+CH3COOH
 +H2O.
+H2O.(5)同时符合下列条件的E的同分异构体有9种,其中分子中有五种不同化学环境的氢,数目比为1:1:2:2:6的结构简式为
 .
.①苯环上有两个侧链
②分子中含有两个甲基
③能发生水解反应且水解产物能使氯化铁溶液显紫色
(6)写出用甲苯为原料(其他无机试剂任选)制备苯甲酸苯甲酯的合成路线:
 .
.
分析 A分子式为C8H10,不饱和度为 $\frac{2×8+2-10}{2}$=4,为苯的同系物,A与氯气在光照条件下发生取代反应生成B,而B中含有一个甲基,故A ,B为
,B为 ,B发生水解反应
,B发生水解反应 ,生成C为
,生成C为 ,
,
D的蒸气与氢气的相对密度为30,则Mr(D)=30×2=60,化合物D完全燃烧生成等物质的量的CO2和H2O,分子中n(C):n(H)=1:2,故D的分子式是C2H4O2,结合E的分子式可知,C与D发生酯化反应生成E,则D为CH3COOH,E为 ,B、C转化都得到F,F与溴发生加成反应生成G,则B、C均发生消去反应生成F,故F为:C6H5CH=CH2,则G为
,B、C转化都得到F,F与溴发生加成反应生成G,则B、C均发生消去反应生成F,故F为:C6H5CH=CH2,则G为 ,据此解答;
,据此解答;
(6)甲苯与氯气在光照条件下得到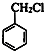 ,在氢氧化钠水溶液、加热条件下水解得到
,在氢氧化钠水溶液、加热条件下水解得到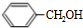 ,甲苯被酸性高锰酸钾溶液氧化得到
,甲苯被酸性高锰酸钾溶液氧化得到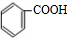 ,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯.
,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯.
解答 解:(1)根据以上分析,D为CH3COOH,化学名称为乙酸,故答案为:乙酸;
(2)反应①为B 发生消去反应生成FC6H5CH=CH2,则反应类型为消去反应,反应②为C
发生消去反应生成FC6H5CH=CH2,则反应类型为消去反应,反应②为C 在浓硫酸加热条件下发生消去反应生成FC6H5CH=CH2,则需要的试剂和反应条件是浓硫酸、加热,故答案为:消去反应;浓硫酸、加热;
在浓硫酸加热条件下发生消去反应生成FC6H5CH=CH2,则需要的试剂和反应条件是浓硫酸、加热,故答案为:消去反应;浓硫酸、加热;
(3)根据以上分析,C为 ,含氧官能团的名称为羟基,F的结构简式为C6H5CH=CH2,故答案为:羟基;C6H5CH=CH2;
,含氧官能团的名称为羟基,F的结构简式为C6H5CH=CH2,故答案为:羟基;C6H5CH=CH2;
.
(4)C+D→E为CH3COOH和 发生的酯化反应,反应方程式为:
发生的酯化反应,反应方程式为: +CH3COOH
+CH3COOH
 +H2O,故答案为:
+H2O,故答案为: +CH3COOH
+CH3COOH
 +H2O;
+H2O;
(5)E的分子式为C10H12O2,苯环上有两个侧链,分子中含有两个甲基,能发生水解反应且水解产物能使氯化铁溶液显紫色,说明含有酚酯,则苯环上有两个侧链可以为:-OOCCH2CH3和-CH3或者-OOCCH3和-CH2CH3或者-OOCH和-CH(CH3)2,每种分别有邻间对三种,所以符合条件的同分异构体共9种,其中分子中有五种不同化学环境的氢,数目比为1:1:2:2:6的结构简式为 ,故答案为:9;
,故答案为:9; ;
;
(6)甲苯与氯气在光照条件下得到 ,在氢氧化钠水溶液、加热条件下水解得到
,在氢氧化钠水溶液、加热条件下水解得到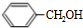 ,甲苯被酸性高锰酸钾溶液氧化得到
,甲苯被酸性高锰酸钾溶液氧化得到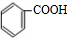 ,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯,合成路线流程图为:
,苯甲酸与苯甲醇在浓硫酸、加热条件下发生转化反应得到苯甲酸苯甲酯,合成路线流程图为: ,
,
故答案为: .
.
点评 本题主要考查有机物结构式的确定、有机化合物的推断、同分异构体的书写和判断、有机反应方程式的书写,易错点为同分异构体的判断,注意正确推断有机物的结构为解答该题的关键,需要学生熟练掌握官能团的性质与转化,题目难度较大.


| A. | 若它们均为金属元素,则X、Y与氧元素组成的物质一定是碱性氧化物 | |
| B. | 若它们的原子最外层电子数之和为11,则它们均为非金属元素 | |
| C. | 若它们均不是金属元素,则非金属性:Z>Y>X | |
| D. | Z元素的最高化合价不一定高于X元素的最高化合价 |
| H2(mol/L) | Cl2(mol/L) | V(mol/L•S) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1,n=2 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=1,n=$\frac{1}{2}$ | D. | m=$\frac{1}{2}$,n=1 |
 )的下列叙述,其中正确的是( )
)的下列叙述,其中正确的是( )①能使酸性KMnO4溶液褪色 ②可发生加聚反应 ③可溶于水 ④不可溶于苯中 ⑤能与浓HNO3发生取代反应 ⑥所有的原子可能共面⑦能发生取代反应.
| A. | ①②④⑤ | B. | ①②⑤⑥⑦ | C. | ①②④⑤⑥ | D. | ①②③④⑤⑥⑦ |
| A. | 不能用铝制的器皿来盛放酸梅汤或碱水是因为铝会和酸或碱反应 | |
| B. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质很稳定 | |
| C. | 铝和NaOH溶液反应:Al+2OH-═Al-+2H2↑ | |
| D. | 纯铝比铝合金的硬度更大、熔点更低 |
 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为
 .
.②工业上可利用反应Cl2(g)+NH3(g)═NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=+11.3 kJ/mol.
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2mol C12和2mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的△H< 0(填“>”或“<”),理由是温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小.
③对该反应,下列说法正确的是AB (填选项字母).
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中Cl2转化率最高的是B 点(填“A”“B”或“C”).
②计算C点时该反应的压强平衡常数Kp(C)=0.5MPa(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
 常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )
常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法不正确的是( )| A. | 水电离出来的c(OH-):D点>B点 | |
| B. | C点存在关系式:c(Na+)=c(HX-)+c(X2-)-c(H+) | |
| C. | B点:c(HX-)>c(H+)>c(X2-)>c(H2X) | |
| D. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}X)}$增大 |
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和Na2CO3的混合液中,各离子浓度的大小关系是c(Na+)>c(CO32-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O═HCO3-+Cl-+HClO | |
| C. | 向0.1mol•L-1 HClO溶液中滴加NaOH溶液至c(HClO):c(ClO-)=1:3,此时溶液pH=8 | |
| D. | 向浓度均为1×10-3mol•L-1的KCl和K2CrO4混合液中滴加1×10-3mol•L-1的AgNO3溶液,CrO42-先形成沉淀 |
| A. | 卤代烃的水解 | B. | 有机物RCN在酸性条件下水解 | ||
| C. | 醛的氧化 | D. | 烯烃的氧化 |