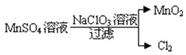
题目内容
5.将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH值最接近于( )| A. | 8.3 | B. | 8 | C. | 9 | D. | 9.7 |
分析 两种碱溶液混合,先计算出混合后溶液的c(OH-),再根据溶液的Kw计算出溶液的c(H+),然后求PH值.
解答 解:pH=8的NaOH溶液中c(OH-)=1×10-6mol/L,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,
混合后c(OH-)=$\frac{1{0}^{-6}+1{0}^{-4}}{2}$mol/L≈$\frac{1{0}^{-4}}{2}$mol/L,
则溶液中的c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{\frac{1{0}^{-4}}{2}}$mol/L=2.0×10-10mol/L,所以PH=10-lg2=9.7,故选D.
点评 本题考查两种碱溶液混合后的溶液氢离子浓度计算,题目难度不大,注意先计算溶液中c(OH-),再计算c(H+).

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
10.某烷烃的结构简式是CH3CH2CH2CH(CH2CH3)CH3,它的正确命名是( )
| A. | 3-甲基己烷 | B. | 2-乙基戊烷 | C. | 4-乙基戊烷 | D. | 2,2-二甲基戊烷 |
16.化学知识中有很多的“相等”.下列叙述正确的是( )
| A. | 原子中原子核内的质子数和中子数一定相等 | |
| B. | 同种元素的原子和离子核外电子数相等 | |
| C. | 化学反应前后,同种元素的原子数目一定相等 | |
| D. | 把一定量的食盐放入水中,得到溶液的质量与食盐和水的总质量一定相等 |
13.下列反应中.既属于氧化还原反应同时又是吸热反应的是( )
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 灼热的碳与高温水蒸气的反应 | ||
| C. | 铝与稀盐酸 | D. | H2与O2的燃烧反应 |
10.下列说法正确的是( )
| A. | 配制FeCl3溶液时,将FeCl3固体溶于适量盐酸中,然后再用水稀释到所需的浓度 | |
| B. | 为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH | |
| C. | 测定溶液的pH时,应先将pH试纸润湿,然后进行检测 | |
| D. | 为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |
17.推理是学习化学的一种重要方法,下列推断正确的是( )
| A. | 由“HF和NH3的水溶液都能导电”,推知二者均为电解质 | |
| B. | 由“某过程发生化学键的断裂”,推知该过程有新物质生成 | |
| C. | 由“化合物是由不同种元素组成的纯净物”,推知只含一种元素的物质一定不是化合物 | |
| D. | 由“同主族元素性质相似,CO2由分子构成”,可推知SiO2也由分子构成 |
18.对下列反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O 判断合理的是( )
| A. | Fe(NO3)x中的x为3 | |
| B. | 标准状况下产生4.48LNO,就有0.6 mol 电子转移 | |
| C. | 稀HNO3 在反应中只作氧化剂 | |
| D. | 磁性氧化铁中的铁元素全部被氧化 |