题目内容
对1-18号元素中(除稀有气体元素外),下列说法错误的是( )
| A、原子半径最小的元素是氢 |
| B、非金属性最强的元素是氟 |
| C、碱性最强的最高价氧化物对应水化物是氢氧化钠 |
| D、气态氢化物中最稳定的是氯化氢 |
考点:元素周期表的结构及其应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:A.电子层越少,半径越小;同周期原子序数大的原子半径小;
B.元素周期表中右上角元素的非金属性强;
C.短周期中Na的金属性最强;
D.非金属性越强,气态氢化物越稳定.
B.元素周期表中右上角元素的非金属性强;
C.短周期中Na的金属性最强;
D.非金属性越强,气态氢化物越稳定.
解答:
解:A.电子层越少,半径越小;同周期原子序数大的原子半径小,则短周期中H原子半径最小,故A正确;
B.元素周期表中右上角元素的非金属性强,则非金属性最强的元素是氟,故B正确;
C.短周期中Na的金属性最强,则短周期中碱性最强的最高价氧化物对应水化物是氢氧化钠,故C正确;
D.非金属性越强,气态氢化物越稳定,则短周期F的非金属性最强,则态氢化物中最稳定的是HF,故D错误;
故选D.
B.元素周期表中右上角元素的非金属性强,则非金属性最强的元素是氟,故B正确;
C.短周期中Na的金属性最强,则短周期中碱性最强的最高价氧化物对应水化物是氢氧化钠,故C正确;
D.非金属性越强,气态氢化物越稳定,则短周期F的非金属性最强,则态氢化物中最稳定的是HF,故D错误;
故选D.
点评:本题考查元素周期表的结构及应用,为高频考点,把握元素的位置及元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
在下列物质中,分别加入金属钠,不能产生氢气的是( )
| A、蒸馏水 | B、乙酸 |
| C、无水乙醇 | D、苯 |
下列说法正确的是( )
| A、在空气质量日报中CO2含量属于空气污染指数 |
| B、碘盐中的碘可以直接用淀粉检验 |
| C、碳酸氢钠可以用于治疗胃酸过多 |
| D、硫酸氢钠属于酸类,其水溶液显强酸性 |
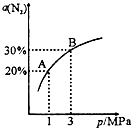 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α%)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α%)与体系总压强(P)的关系如图所示.下列说法正确的是( )| A、将1.0mol氮气和3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ |
| B、平衡状态由A变到B时,平衡常数K(A)<K(B) |
| C、上述反应在达到平衡后,增大压强,H2的转化率提高 |
| D、升高温度,平衡向逆反应方向移动 |
下列物质属于电解质的是( )
①石墨②熔融NaOH③盐酸④NH3?H2O⑤三氧化硫.
①石墨②熔融NaOH③盐酸④NH3?H2O⑤三氧化硫.
| A、①② | B、②⑤ | C、③④ | D、②④ |
已知热化学方程式:2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ/mol.则对于热化学方程式:2H2O(l)=2H2(g)+O2(g)△H2=b,下列说法正确的是( )
| A、热化学方程式中化学计量数表示分子个数 |
| B、该反应的△H2=+483.6 kJ/mol |
| C、△H2<△H1 |
| D、△H2>△H1 |
已知2KmnO4+16HCI=2KC1+2MnCI2+5C12↑+8H20;K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O
MnO2+4HCl═MnCl2+Cl2↑+2H2O ;其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(>6mol?L-1)反应,MnO2需和浓盐酸(>8mol?L-1)反应.以下结论中,不正确的是 ( )
MnO2+4HCl═MnCl2+Cl2↑+2H2O ;其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(>6mol?L-1)反应,MnO2需和浓盐酸(>8mol?L-1)反应.以下结论中,不正确的是 ( )
| A、上述反应既属于氧化还原反应,又属于离子反应 |
| B、生成1molCl2转移电子数均为2NA(NA为阿伏加德罗常数) |
| C、氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
| D、盐酸的浓度越大,Cl-的还原性越强 |