题目内容
4.将二氧化硫气体通入氯化钡溶液至饱和,无沉淀生成,再通入气体甲有白色沉淀生成,则气体甲可能是( )| A. | N2 | B. | NH3 | C. | CO2 | D. | HCl |
分析 亚硫酸的酸性弱于盐酸,SO2气体通入BaCl2溶液中,未见白色沉淀,不发生反应,继续通入另一种气体立即产生沉淀,沉淀可能为硫酸钡或亚硫酸钡,也可能为S,则气体具有氧化性或碱性等,以此来解答.
解答 解:A.通入氮气,不发生化学反应,没有沉淀,故A错误;
B.氨气溶于水生成一水合氨,一水合氨电离产生氢氧根离子,溶液显碱性,通入二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡沉淀,故B正确;
C.碳酸酸性弱于盐酸,依据强酸制备弱酸规律,将SO2气体通入BaCl2溶液至饱和,无沉淀生成,再通入气体二氧化碳,不会发生反应,不会产生成沉淀,故C错误;
D.氯化氢与二氧化硫、氯化钡均不反应,不会产生沉淀,故D错误.
故选B.
点评 本题考查了二氧化硫的性质,为高频考点,侧重考查学生的双基知识,熟悉SO2是酸性氧化物、还原性和氧化性的性质是解题关键,题目难度不大,注重基础知识夯实.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
19.下列混合物可用加热方法分离的是( )
| A. | 晶体碘和氯化铵 | B. | 碳酸钙和二氧化锰 | ||
| C. | 硫酸钾和氯酸钾 | D. | 氯化铵和氯化钡 |
9.下列溶液中通入足量SO2后,最终一定会出现沉淀的是( )
| A. | Na2S | B. | BaCl2 | C. | Ba(NO3)2 | D. | Ca(OH)2 |
16.下列事实和所得出相应结论均完全正确的是( )
| 实验事实 | 结论 | |
| A | 常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 | 氮气的化学性质比磷稳定 |
| B | CO2的水溶液可导电 | CO2是电解质 |
| C | SO2通入到氯化钡溶液中出现白色沉淀 | 沉淀为亚硫酸钡 |
| D | 向某无色溶液中滴入少量NaOH溶液,用湿润的红色石蕊试纸放在试管口检验,试纸不变蓝色 | 无色溶液中不含NH4+ |
| A. | A | B. | B | C. | C | D. | D |
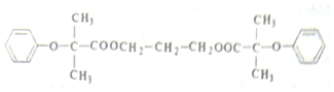
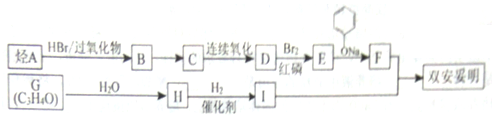
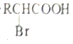 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$
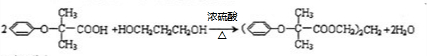 .
.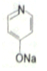 (
( 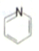 与苯环性质相似)与
与苯环性质相似)与  合成
合成 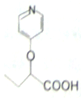 的路线:
的路线: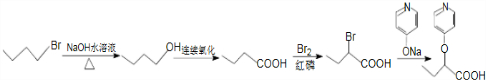 .
.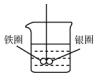 如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平痕.小心地从烧杯中央滴入CuSO4溶液.
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平痕.小心地从烧杯中央滴入CuSO4溶液. 氧化锌、硫化锌都是重要的基础化工原料.
氧化锌、硫化锌都是重要的基础化工原料.