题目内容
下列有关实验操作的叙述正确的是( )
| A、用量筒取5.00mL 1.00mol/L盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol/L盐酸 |
| B、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| C、用10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15% |
考点:配制一定物质的量浓度的溶液,物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:A、容量瓶不能用于稀释浓溶液;
B、容量瓶不能用于溶解固体;
C、硫酸溶液浓度越大,则密度越大,据此分析;
D、根据等质量两种不同质量分数的同种溶液混合时,溶质质量分数为:两种质量分数加起来除以2,如果不等质量混合,溶质质量分数就偏向于质量大的溶液的质量分数.
B、容量瓶不能用于溶解固体;
C、硫酸溶液浓度越大,则密度越大,据此分析;
D、根据等质量两种不同质量分数的同种溶液混合时,溶质质量分数为:两种质量分数加起来除以2,如果不等质量混合,溶质质量分数就偏向于质量大的溶液的质量分数.
解答:
解:A、容量瓶不能用于稀释浓溶液,浓溶液必须在烧杯里稀释并冷却好后移液至容量瓶中,故A错误;
B、容量瓶不能用于溶解固体,固体必须在烧杯里溶解并冷却后移液至容量瓶中,故B错误;
C、设98%的H2SO4的密度为ρ1,稀释至100ml后溶液的密度为ρ2,硫酸溶液浓度越大,则密度越大,故有ρ1>ρ2;由于稀释前后溶质的质量不变,则稀释后溶液的质量分数ω%=
>
=9.8%,故稀释后质量分数大于9.8%,故C错误;
D、10%的氨水与20%的氨水等质量混合时溶质的质量分数为:
=15%,如果等体积混合时,由于20%的氨水的密度小于10%的氨水的密度,所以10%的氨水的质量大于20%的氨水的质量,所以混合后溶质质量分数偏向于10%的氨水,所以质量分数小于15%,故D正确.
故选D.
B、容量瓶不能用于溶解固体,固体必须在烧杯里溶解并冷却后移液至容量瓶中,故B错误;
C、设98%的H2SO4的密度为ρ1,稀释至100ml后溶液的密度为ρ2,硫酸溶液浓度越大,则密度越大,故有ρ1>ρ2;由于稀释前后溶质的质量不变,则稀释后溶液的质量分数ω%=
| 10ml×ρ1×98% |
| 100ml×ρ2 |
| 10ml×ρ1×98% |
| 100ρ1 |
D、10%的氨水与20%的氨水等质量混合时溶质的质量分数为:
| 10%+20% |
| 2 |
故选D.
点评:本题考查了容量瓶的使用和浓硫酸、氨水的稀释问题,需要注意的是硫酸溶液浓度越大,则密度越大,而氨水的浓度越大,密度越小.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、标准标况下,22.4L水所含的分子数目为6.02×1023个 |
| B、2g氢气所含氢原子数目为2×6.02×1023个 |
| C、500ml2mol?L-1的Ba(NO3)2溶液中含NO3-离子数为2×6.02×1023个 |
| D、0.5mol氯气分子中含Cl原子数为6.02×1023个 |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是( )
A、 实验室中制取少量蒸馏水 |
B、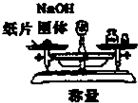 城区一定质量的NaOH固体 |
C、 用滴瓶长期保存NaOH溶液 |
D、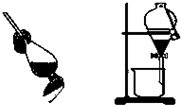 除去乙醇中溶有的少量水 |
在配制一定物质的量浓度的硫酸溶液时,下列错误操作可使所配制溶液浓度偏高的是( )
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、定容时仰视容量瓶瓶颈刻度线 |
| D、摇匀后见液面下降,再加水至刻度线 |
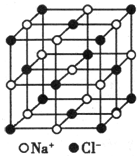 纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )| A、87.5% | B、92.9% |
| C、96.3% | D、100% |
加入镁粉后会产生氢气的溶液中能大量共存的无色透明离子组是( )
| A、K+、Na+、NO3-、MnO4- |
| B、K+、Na十、Br-、CO32- |
| C、Mg2+、Na+、Cl-、SO42- |
| D、Na十、Ba2+、OH-、SO42- |
4月22日是世界地球日,我国今年的地球日主题为--“珍惜地球资源,转变发展方式,倡导低碳生活”.下列有关做法与此不相符的是( )
| A、大量进口石油,减少煤炭使用量 |
| B、回收废弃饮料包装纸,制作成公园内的休闲长椅 |
| C、在西部和沿海地区兴建风力发电站,解决能源问题 |
| D、鼓励购买小排量汽车,推广与发展电动、混合动力汽车 |