题目内容
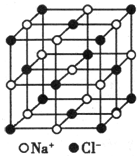 纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )| A、87.5% | B、92.9% |
| C、96.3% | D、100% |
考点:晶胞的计算
专题:化学键与晶体结构
分析:根据晶胞的结构计算纳米颗粒的表面原子占总原子数的百分比.
解答:
解:由NaCl的晶胞图可知,NaCl的晶胞为正立方体结构,立方体的体心只有一个Na+,而其它的离子都处在立方体的面上,晶胞中的总原子数为27个,而表面上就有26个,故“NaCl”纳米颗粒的表面原子占总原子数的百分比为
×100%=96.3%,
故选C.
| 26 |
| 27 |
故选C.
点评:本题考查物质结构和性质、晶胞的结构分析,题目难度一般,注意氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形,但不是晶胞.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
下列有关实验操作的叙述正确的是( )
| A、用量筒取5.00mL 1.00mol/L盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol/L盐酸 |
| B、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| C、用10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15% |
 对于反应mA(g)+nB(g)?pC(g)+qD(g),当其他条件不变,温度分别为T1和T2时,反应物B的质量分数与反应时间(t)的关系分别可用图中曲线I和曲线Ⅱ表示.据此下列判断中,正确的是( )
对于反应mA(g)+nB(g)?pC(g)+qD(g),当其他条件不变,温度分别为T1和T2时,反应物B的质量分数与反应时间(t)的关系分别可用图中曲线I和曲线Ⅱ表示.据此下列判断中,正确的是( )| A、T1>T2 |
| B、T2>Tl |
| C、正反应是吸热反应 |
| D、Tl温度下转化率更高 |
下表是常温下某些一元弱酸的电离常数:则0.1mol/L的下列溶液中,c(H+)最大的是( )
| 弱酸 | HCN | HF | CH3COOH | HNO2 |
| 电离常数 | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A、HCN |
| B、HF |
| C、CH3COOH |
| D、HNO2 |
下列基本实验操作中,正确的是( )
A、 气体除杂 |
B、 收集氧气 |
C、 稀释溶液 |
D、 滴加溶液 |
 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )| A、X是活泼的非金属 |
| B、三种元素中Y的非金属性最强 |
| C、Z的最高价氧化物的水化物是强酸 |
| D、Y的最高价氧化物的水化物是一种强酸 |
下列各组物质中,不管它们以何种比例混合只要总质量一定,充分燃烧后生成的二氧化碳的质量不变的是( )
| A、乙炔和苯 |
| B、乙醇和丙醇(CH3CH2CH2OH) |
| C、乙酸和乙二醇(HOCH2-CH2OH) |
| D、甲醇CH3OH和乙酸 |