题目内容
5.表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的是( )| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | CuSO4 | FeSO4 | 加入过量铁粉,过滤 |
| B. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.铁置换出铜;
B.碳酸钙不溶于水,可过滤分离;
C.酒精与水混溶;
D.生成氯化钠,引入新杂质.
解答 解:A.铁置换出铜,生成硫酸亚铁,不能除去杂质,反而影响被提纯物质,故A错误;
B.碳酸钙不溶于水,可过滤分离,可除去杂质,然后蒸发结晶可得到硝酸钠,故B正确;
C.酒精与水混溶,不能用作萃取剂,可用苯或四氯化碳,故C错误;
D.生成氯化钠,引入新杂质,应加入KCl除杂,故D错误.
故选B.
点评 本题考查物质的分离和提纯的实验方案的设计与评价,为高频考点,侧重考查学生的分析、实验能力,题目难度不大,注意除杂时不能引入新的杂质,且不能影响被提纯物质的性质.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
6.聚甲基丙烯酸甲酯的(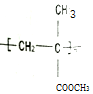 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
 )缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )
)缩写代号为PMMA.俗称有机玻璃.下列说法中错误的是( )| A. | 合成PMMA的单体是甲基丙烯酸和甲醇 | |
| B. | 聚甲基丙烯酸甲酯的分子式可表示为(C5H8O2)n | |
| C. | 聚甲基丙烯酸甲酯属于有机高分子合成材料 | |
| D. | 甲基丙烯酸甲酯[CH2=C(CH3)COOCH3]中碳原子可能都处于同一平面 |
16.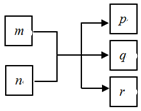 短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且分布在三个不同的周期里.Y元素的焰色为黄色.由上述元素组成的物质之间的转化关系如图(反应条件略去),其中m、n、p化合物,q、r是单质,r通常为黄绿色气体,常温下0.01mol•L-1 p溶液的pH为12.下列说法不正确的是( )| A. | 简单离子半径的大小:Y<X<Z | |
| B. | X的简单氢化物的沸点在同族元素中最高 | |
| C. | Y分别与W、Z形成的两种化合物中化学键类型相同 | |
| D. | Z的氧化物对应的水化物为强酸 |
10.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF<HCl<HBr<HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 最外层电子数Li<Mg<Si<Ar |
14.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 2.7克金属铝变为铝离子时失去的电子数目为0.3NA | |
| B. | 标准状况,0.5molN2含有的分子数为0.5NA | |
| C. | 在常温、常压下,1molHCl、H2O或I2所含有的分子数都为 NA | |
| D. | 在同温、同压下,相同物质的量的任何气体单质所含有的原子数相同 |
15.下列物质的性质与应用对应关系正确的是( )
| A. | 炭具有强还原性,高温下能将二氧化硅还原为硅 | |
| B. | 碳酸氢钠能与碱反应,可用作食品的蓬松剂 | |
| C. | 浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 | |
| D. | 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁 |
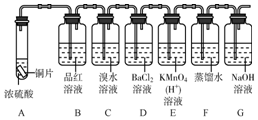 下面是某同学学习硫元素的学习方案.
下面是某同学学习硫元素的学习方案.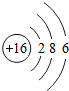 ,从结构知道硫元素是一种典型非金属元素.
,从结构知道硫元素是一种典型非金属元素. ,其电子所占据的电子层中,能量最高的是M层(填符号).
,其电子所占据的电子层中,能量最高的是M层(填符号).