题目内容
下列物质中既含有共价键又含离子键的化合物是( )
| A、MgCl2 |
| B、NaOH |
| C、K2O |
| D、C6H6 |
考点:离子化合物的结构特征与性质,共价键的形成及共价键的主要类型
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答:
解:A.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间只存在共价键,故B正确;
C.氧化钾中钾离子和氧离子之间只存在离子键,为离子化合物,故C错误;
D.苯中相邻碳原子之间存在非极性键、C原子和氢原子之间存在极性键,为共价化合物,故D错误;
故选B.
B.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间只存在共价键,故B正确;
C.氧化钾中钾离子和氧离子之间只存在离子键,为离子化合物,故C错误;
D.苯中相邻碳原子之间存在非极性键、C原子和氢原子之间存在极性键,为共价化合物,故D错误;
故选B.
点评:本题考查了化合物和化学键的关系,明确物质的构成微粒及微粒间的作用力是解本题关键,注意氯化镁中两个氯离子之间不存在化学键,为易错点.

练习册系列答案
相关题目
对反应A+B?AB来说,常温下按以下情况进行反应:①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol③0.1mol?L-1的A、B溶液各10mL ④0.5mol?L-1的A、B溶液各50mL四者反应速率的大小关系是( )
| A、②>①>④>③ |
| B、④>③>②>① |
| C、①>②>④>③ |
| D、①>②>③>④ |
下列物质中,属于酸性氧化物但不溶于水的是( )
| A、三氧化硫 | B、二氧化硅 |
| C、二氧化碳 | D、氧化铁 |
下列说法正确的是( )
| A、含有离子键的化合物一定是离子化合物 |
| B、含有共价键的化合物一定是共价化合物 |
| C、全部由非金属元素组成的化合物一定是共价化合物 |
| D、H2SO4溶于水能电离出H+和SO42-,所以H2SO4是离子化合物 |
根据所学知识,判断下列反应不能发生的是( )
| A、Cl2+2KBr═2KCl+Br2 | ||||
| B、2NaCl+I2═Cl2+2NaI | ||||
| C、Cl2+2HI═2HCl+I2 | ||||
D、MnO2+4HCl(浓)
|
下列表示物质结构的化学用语或模型正确的是( )
A、苯分子的比例模型: |
B、CO2的电子式: |
C、Cl-离子的结构示意图: |
| D、乙烯的结构式:CH2=CH2 |
熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池.已知该电池总反应为:2CO+O2═2CO2.则下列说法中正确的是( )
| A、通CO的一极是电池的正极 |
| B、该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C、负极反应式:O2+2CO2+4e-═2CO32- |
| D、该电池工作过程中有蓝色火焰产生 |
已知铅蓄电池Pb+PbO2+2H2SO4═2PbSO4+2H2O 在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”.下列说法中正确的是( )
| A、标有“+”的接线柱,充电时作阳极,放电时作负极 |
| B、放电时PbO2作正极,电池工作一段时间后电解质溶液密度会减少 |
| C、充电时电路中通过0.1mol电子时,电解质溶液有0.2mol H2SO4产生 |
| D、充电时阳极中PbSO4被还原为PbO2 |
下列表示对应化学反应的离子方程式正确的是( )
A、向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O
| ||
B、苯酚钠溶液中通入少量CO2: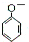 +H2O+CO2→ +H2O+CO2→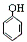 +HCO3- +HCO3- | ||
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-═NH3?H2O+H2O | ||
| D、氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH-→CH2ClCOO-+H2O |