题目内容
已知:①CH3OH (g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
A.CH3OH转变成H2的过程一定要吸收能量
B.①反应中,反应物的总能量高于生成物总能量
C.根据②推知反应:CH3OH(l)+ O2(g)===CO2(g)+2H2(g)的
O2(g)===CO2(g)+2H2(g)的
ΔH>-192.9 kJ·mol-1
D.反应②中的能量变化如下图所示

C
【解析】 A项,①反应吸收热量;②反应放出热量;B项,①反应是吸热反应,所以反应物总能量小于生成物总能量;C项,液态乙醇转化为气态乙醇需要吸收热量,放热少,所以ΔH>-192.9 kJ·mol-1;D项,O2、H2前面的化学计量数不对。

 轻松课堂标准练系列答案
轻松课堂标准练系列答案某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下。

已知:
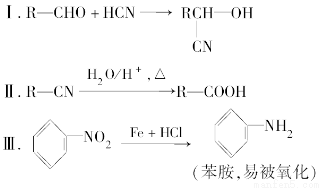
请回答下列问题:
(1)C的分子式为________。
(2)下列对相关反应类型的判断合理的是________(填序号)。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:_____________________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有________种,写出其中一种的结构简式:________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为__________________________________________。
②写出反应Ⅴ的化学方程式:_______________________________________。
保护环境已成为当前和未来的一项全球性重大课题。为解决目前燃料使用过程中的环境污染问题,并缓解能源危机,有的专家提出利用太阳能促使燃料循环使用的构想,如图所示:

过程Ⅰ可用如下反应表示:
①2CO2 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O 4NH3+3O2 ④2CO2+4H2O
4NH3+3O2 ④2CO2+4H2O 2CH3OH+3O2 ⑤2CO+4H2O
2CH3OH+3O2 ⑤2CO+4H2O ________+3O2
________+3O2
请回答下列问题:
(1)过程Ⅰ的能量转化形式为________能转化为________能。
(2)请完成第⑤个反应的化学方程式:____________________。
(3)上述转化过程中,ΔH1和ΔH2的关系是________。
(4)断裂1 mol化学键所需的能量见下表:
共价键 | H—N | H—O | N≡N | O===O |
断裂1 mol化学键所需能量/(kJ·mol-1) | 393 | 460 | 941 | 499 |
常温下,N2与H2O反应生成NH3的热化学方程式为_________。
某研究小组欲探究SO2的化学性质,设计了如下实验方案。

(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为_____________________________________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
实验操作 | 预期现象和结论 |
将D中沉淀过滤,洗涤干净备用 |
|
用另一干净试管取少量沉淀样品,加入______________ | _________________________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。




