题目内容
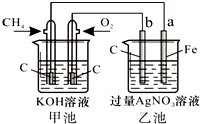 如图,根据所学知识填空:
如图,根据所学知识填空:(1)乙池中b电极作
(2)写出甲池中负极的电极反应式
(3)最初a和b两个电极质量相同,当电路中转移电子的物质的量为0.2mol时,a和b两电极质量变化差为
考点:原电池和电解池的工作原理
专题:
分析:(1)乙池中b与原电池的正极相连,所以b是阳极,a与原电池的负极相连是阴极,所以电极反应式是Ag++e-=Ag;
(2)碱性条件下,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(3)随放电的进行,阳极b的质量不变,而阴极a银离子放电,质量增加,由此分析解答.
(2)碱性条件下,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
(3)随放电的进行,阳极b的质量不变,而阴极a银离子放电,质量增加,由此分析解答.
解答:
解:(1)乙池中b与原电池的正极相连,所以b是阳极,a与原电池的负极相连是阴极,所以电极反应式是Ag++e-=Ag,故答案为:阳极;8Ag++8e-=8Ag或Ag++e-=Ag;
(2)燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+8e-+10OH-=CO32-+7H2O;
(3)当电路中转移电子的物质的量为0.2mol时,根据电极反应式是Ag++e-=Ag,则生成0.2mol的银,所以a和b两电极质量变化差为 0.2×108=21.6,故答案为:21.6.
(2)燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+8e-+10OH-=CO32-+7H2O;
(3)当电路中转移电子的物质的量为0.2mol时,根据电极反应式是Ag++e-=Ag,则生成0.2mol的银,所以a和b两电极质量变化差为 0.2×108=21.6,故答案为:21.6.
点评:本题考查电化学的原理,电极反应式的书写,然后根据质量差综合分析解题,比较容易.

练习册系列答案
相关题目
下列物质分子的电子式正确的是( )
A、CH3Cl |
B、羟基 |
C、CO2 |
D、C2H4 |
下列各式中,表示水解反应的是( )
| A、H2O+H2O?H3O++OH- |
| B、CO32-+H2O?HCO3-+OH- |
| C、NH3+H2O?NH3?H2O |
| D、HCO3-+H2O?H3O++CO32- |
某商用锂离子电池以石墨为负极材料,以LiCoO2为正极材料,电解质为LiPF6与乙烯碳酸酯,电池充电时,锂离子从正极材料中出来进入负极,放电时则反应过来,下列说法中,不正确的是( )
| A、充电时发生的正极反应为:LiCoO2═Li1-xCoO2+xLi+xe- |
| B、负极反应xLi+xe-+6C═LixC6 |
| C、正极材料Li1-xCoO2中的Co充电时被氧化,从Co3+变为Co4+,放电时被还原,从Co4+变为Co3+ |
| D、LiAlO2和LiMnO4等也可做正极材料 |
下列关于化学反应能量变化的说法中正确的是( )
| A、凡需要加热的化学反应一定是吸热反应 |
| B、酸碱中和反应,燃烧反应一定是放热反应 |
| C、使用催化剂的化学反应一定是吸热反应 |
| D、氧化还原反应和化合反应一定是放热反应 |
既含共价键又含离子键的离子化合物是( )
| A、HClO4 |
| B、NaCl |
| C、KOH |
| D、MgCl2 |
 如图所示在通常状况下,A为固态单质.根据下图转化关系,回答:
如图所示在通常状况下,A为固态单质.根据下图转化关系,回答:
