题目内容
下列各种溶液中,粒子物质的量浓度关系正确的是( )
| A、草酸氢钾溶液呈酸性,0.1mol/LKHC2O4:c(H2C2O4)>c(C2O42-) |
| B、0.2mol?L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C、0.1mol?L-1(NH4)2SO4溶液:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D、0.2mol?L-1NaHCO3溶液:c(H+)+c(Na+)=c(OH-)+c(HCO3-)+c(CO32-) |
考点:离子浓度大小的比较
专题:电离平衡与溶液的pH专题
分析:A.草酸氢钾溶液呈酸性,则HC2O4-电离程度大于水解程度;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,根据电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,根据电荷守恒判断;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答:
解:A.草酸氢钾溶液呈酸性,则HC2O4-电离程度大于水解程度,所以c(H2C2O4)<c(C2O42-),故A错误;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒得c(Na+)=2c(H2CO3)+2c(HCO3-)+2c(CO32-),所以得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B正确;
C.硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,根据电荷守恒得c(SO42-)<c(NH4+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选B.
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒得c(Na+)=2c(H2CO3)+2c(HCO3-)+2c(CO32-),所以得c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B正确;
C.硫酸铵为强酸弱碱盐,铵根离子水解导致溶液呈酸性,根据电荷守恒得c(SO42-)<c(NH4+),故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,明确溶液中的电解质及溶液酸碱性结合电荷守恒、物料守恒来分析解答,题目难度不大.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案
相关题目
电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )
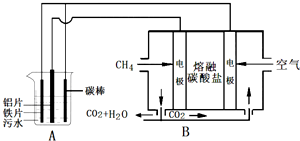

| A、装置A中碳棒为阴极 |
| B、装置B中通入空气的电极反应是O2+2H2O+4e-═4OH- |
| C、污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果 |
| D、标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L |
欲检验某无色溶液中是否含有SO42-,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
| A、先加稀盐酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| B、先加稀硝酸将溶液酸化,再滴加氯化钡溶液,看是否生成白色沉淀 |
| C、直接向溶液中滴加稀硝酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
| D、直接向溶液中滴加稀盐酸酸化过的氯化钡溶液,看是否生成白色沉淀 |
下列反应的离子方程式书写正确的是( )
| A、铝与氢氧化钠溶液反应:Al+4OH-═[Al(OH)4]-+H2↑ |
| B、氯化铝溶液中加入过量的氨水:Al3++4NH3?H2O═[Al(OH)4]-+4NH4+ |
| C、氯化铁溶液中加入铜粉:Fe3++Cu═Cu2++Fe2+ |
| D、氯化铜溶液中加入锌粉:Cu2++Zn═Cu+Zn2+ |
下列离子方程式书写正确的是( )
| A、把过量碳酸氢钠溶液加入到氢氧化钡溶液中:2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O |
| B、向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7(常温时):Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、标况下112mL Cl2通入10mL 1mol/L的FeBr2溶液:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
下列各物质:①3.01×1023个CH4②标况44.8L C02③17gNH3的物质的量由多到少的顺序是( )
| A、②③① | B、②①③ |
| C、①②③ | D、③②① |
下列离子方程式中正确的是( )
| A、氨水与亚硫酸溶液混合:NH3?H2O+H+═NH4++H2O | ||||
| B、SO2通入漂白粉溶液中:Ca(ClO)2+SO2+H2O═CaSO3↓+2HClO | ||||
C、铜与浓硫酸共热:Cu+4H++SO42-
| ||||
| D、把H2S通入CuSO4溶液中:H2S+Cu2+═CuS↓+2H+ |
下列有关化学用语正确的是( )
A、HCl的电子式为 | ||
B、Cl-的结构示意图  | ||
C、氮气的电子式  | ||
D、质量数为37的氯原子
|
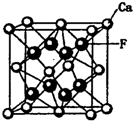 碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:
碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题: